Kinh Nghiệm về Nước tự nhiên là gì trong hóa học 2022
Cao Nguyễn Bảo Phúc đang tìm kiếm từ khóa Nước tự nhiên là gì trong hóa học được Cập Nhật vào lúc : 2022-04-24 13:13:11 . Với phương châm chia sẻ Bí kíp Hướng dẫn trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi tham khảo nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Mình lý giải và hướng dẫn lại nha.
- Nước tự nhiên là một hỗn hợp vì trong nước tự nhiên có lẫn một số trong những chất khoáng.
Nội dung chính- Màu sắc và hình dángHình học của phân tử nướcTính lưỡng cựcLiên kết hiđrôTrong phòng thí nghiệmTrong sinh hoạtVideo liên quan
Hóa học, một nhánh của khoa học tự nhiên, là ngành nghiên cứu và phân tích về thành phần, cấu trúc, tính chất, và sự thay đổi của vật chất.Hóa học nói về những nguyên tố, hợp chất, nguyên tử, phân tử, và những phản ứng hóa học xảy ra Một trong những thành phần đó.Hóa học đôi khi được gọi là "khoa học trung tâm" vì nó là cầu nối những ngành khoa học tự nhiên khác ví như vật lý học, địa chất học và sinh học.
Lớp 8 - Năm thứ ba ở cấp trung học cơ sở, học tập khởi đầu nặng dần, sang năm lại là năm cuối cấp áp lực lớn dần nhưng những em vẫn phải để ý quan tâm sức khỏe nhé!

Nước là một hợp chất vô cơ, trong suốt, không vị, không mùi và gần như thể không màu, là thành phần chính của thủy quyển Trái đất và chất lỏng trong tất cả những sinh vật sống đã biết (trong đó nó hoạt động và sinh hoạt giải trí như một dung môi[5]). Nước rất quan trọng đối với tất cả những dạng sống đã biết, tuy nhiên nó không đáp ứng calo hoặc chất dinh dưỡng hữu cơ. Công thức hóa học của nó là H2O, nghĩa là mỗi phân tử của nó chứa một nguyên tử oxy và hai nguyên tử hydro, được nối với nhau bằng link cộng hóa trị. Hai nguyên tử hydro link với một nguyên tử oxy một góc 104,45°.[6]
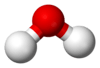 Nước (H2O)
Nước (H2O)
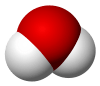
Cấu trúc phân tử cơ bản của nước

Nước và giọt nước
Danh pháp IUPACwater, oxidaneTên khácHydrogen oxide, Dihydrogen monoxide (DHMO), Hydrogen monoxide, Dihydrogen oxide, Hydrogen hydroxide (HH hoặc HOH), Hydric acid, Hydrohydroxic acid, Hydroxic acid, Hydrol,[1] μ-Oxido dihydrogenNhận dạngSố CAS7732-18-5PubChem962ChEBI15377Số RTECSZC0110000Ảnh Jmol-3DảnhSMILES
đầy đủ
O
917 kg/m³ (solid)
see textĐiểm nóng chảy 0 °C (273 K; 32 °F) [2]Điểm sôi 100 °C (373 K; 212 °F) [2]Độ hòa tanÍt hòa tan được haloalkanes, aliphatic và aromatic hydrocarbons, ethers.[3] Hòa tan được một phần carboxylates, Alcohol, Keton, Amin. Hòa tan hoàn toàn methanol, ethanol, isopropanol, acetone, glycerol.Áp suất hơi(Cần tương hỗ update)Độ axit (pKa)15.74
~35-36Độ bazơ (pKb)15.74MagSus−1.298·10−5 cm³/mol (20 °C, 1 atm)Độ dẫn nhiệt0.58 W/m·K[4]Chiết suất (nD)1.3325Độ nhớt1 cP (20 °C)Cấu trúcCấu trúc tinh thểHexagonalHình dạng phân tửBentMômen lưỡng cực1.85 DNhiệt hóa họcEntanpi
hình thành ΔfHo298-285.83 kJ/mol[3]Entropy mol tiêu chuẩn So29869.95 J/mol·KNhiệt dung75.375 ±0.05 J/mol·KCác nguy hiểmNguy hiểm chínhChết đuối (xem thêm Trò lừa dihydro monoxide)
Ngộ độc nước
Tuyết lở (dưới dạng tuyết)NFPA 704

0
0
0
Điểm bắt lửaCóCác hợp chất liên quanCation khácHydro sulfide
Hydrogen selenide
Hydrogen telluride
Hydrogen polonide
Hydro peroxidNhóm chức liên quanAcetone
MethanolHợp chất liên quanNước nặng
Băng
Nước siêu nặng
Trừ khi có ghi chú khác, tài liệu được đáp ứng cho những vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
![]() Y kiểm chứng (cái gì
Y kiểm chứng (cái gì ![]() Y
Y![]() N ?)
N ?)
Tham khảo hộp thông tin
"Nước" là tên gọi trạng thái lỏng của H2O ở điều kiện tiêu chuẩn về nhiệt độ và áp suất. Nó tạo thành kết tủa dưới dạng mưa và sol khí dưới dạng sương mù. Mây gồm có những giọt nước và băng lơ lửng, ở trạng thái rắn. Khi được phân chia dạng mịn, nước đá kết tinh hoàn toàn có thể kết tủa dưới dạng tuyết. Trạng thái khí của nước là hơi nước.
Nước bao trùm 71% mặt phẳng Trái đất, đa phần ở những biển và đại dương.[7] Một phần nhỏ nước xuất hiện dưới dạng nước ngầm (1,7%), trong những sông băng và chỏm băng ở Nam Cực và Greenland (1,7%), và trong không khí dưới dạng hơi, mây (gồm có băng và nước lỏng lơ lửng trong không khí) và giáng thủy (0,001%).[8][9] Nước di tán liên tục theo quy trình nước bốc hơi, thoát hơi nước, ngưng tụ, kết tủa và dòng chảy, thường là đi ra biển.
Nước đóng một vai trò quan trọng trong nền kinh tế tài chính thế giới. Khoảng 70% lượng nước ngọt mà con người tiêu dùng được dùng cho nông nghiệp.[10] Đánh bắt cá ở những vùng nước mặn và nước ngọt là nguồn đáp ứng thực phẩm chính cho nhiều nơi trên thế giới. Phần lớn thương mại đường dài của những sản phẩm & hàng hóa (như dầu mỏ, khí đốt tự nhiên và những sản phẩm sản xuất) được vận chuyển bằng thuyền qua những biển, sông, hồ và kênh đào. Một lượng lớn nước, đá và hơi nước được sử dụng để làm mát và sưởi ấm, trong công nghiệp và mái ấm gia đình. Nước là một dung môi tuyệt vời cho nhiều loại chất cả vô cơ và hữu cơ; vì vậy nó được sử dụng rộng rãi trong những quy trình công nghiệp, nấu ăn và giặt giũ. Nước, băng và tuyết cũng là trung tâm của nhiều môn thể thao và những hình thức vui chơi khác, ví dụ như lượn lờ bơi lội, chèo thuyền vui chơi, đua thuyền, lướt sóng, câu thành viên thao, lặn, trượt băng và trượt tuyết.
Mô hình phân tử nước
Nước tinh khiết thường được mô tả là không vị và không mùi, tuy nhiên con người dân có cảm ứng đặc biệt hoàn toàn có thể cảm nhận được sự xuất hiện của nước trong miệng, và ếch được biết là hoàn toàn có thể ngửi thấy nó. Tuy nhiên, nước từ những nguồn thông thường (gồm có nước khoáng đóng chai) thường có nhiều chất hòa tan, hoàn toàn có thể làm cho nó có nhiều mùi vị và mùi rất khác nhau. Con người và những động vật khác đã phát triển những giác quan được cho phép họ đánh giá được chất lượng của nước bằng phương pháp tránh nước quá mặn hoặc quá hôi.
Màu sắc và hình dáng
Màu sắc tự nhiên của nước thường được xác định bởi những chất rắn lơ lửng và chất lơ lửng, hoặc bằng phương pháp phản chiếu khung trời, hơn là vì nước. Điều này nghĩa là sắc tố của nước phụ thuộc vào góc phản xạ và khúc xạ của ánh sáng chiếu đến.
Ánh sáng trong phổ điện từ nhìn thấy hoàn toàn có thể đi qua một vài mét nước tinh khiết (hoặc băng) mà không còn sự hấp thụ đáng kể, vì vậy nó trông trong suốt và không màu. Như vậy thực vật thủy sinh, tảo, và sinh vật quang hợp khác hoàn toàn có thể sống trong nước sâu đến hàng trăm mét, chính bới ánh sáng mặt trời hoàn toàn có thể tiếp cận chúng. Hơi nước cơ bản không nhìn thấy được như một chất khí.
Tuy nhiên, với độ dày 10m trở lên, sắc tố của nước (hoặc băng) là màu ngọc lam (màu xanh lục nhạt), vì phổ hấp thụ của nó có độ sắc nét tối thiểu ở màu tương ứng của ánh sáng (1/227 m −1 tại 418 nm). Màu sắc trở nên ngày càng mạnh mẽ và tự tin và tối hơn với độ dày ngày càng tăng. (Thực tế không còn ánh sáng mặt trời đến được những phần của đại dương dưới độ sâu 1000 mét) Mặt khác, tia cực tím bị nước hấp thụ mạnh. Và do thiếu ánh sáng và áp lực vô cùng lớn, như Rãnh Mariana, hơn 1 × 10 8 displaystyle 1times 10^8 N / m 2 displaystyle N/m^2 . Do đó không sinh vật nào hoàn toàn có thể sống dưới đáy đại dương này.
Các chỉ số khúc xạ của nước lỏng ( 1.333 ở 20 °C ) là cao hơn nhiều so với không khí (1.0), tương tự như của alkan và ethanol, nhưng thấp hơn so với glycerol (1,473), benzen (1,501), carbon disulfide (1.627), và nhiều chủng loại kính phổ biến ( 1.4 đến 1.6 ). Chỉ số khúc xạ của băng (1.31) thấp hơn lượng nước.
Nước không còn hình dạng nhất định, nó chỉ tồn tại hình dạng tại thuở nào điểm trong vật mà nó chứa. Nó có cấu trúc phân tử di tán trượt lên nhau và do đó nước rất dễ mất hình dạng, tuy vậy nước rất khó nén, tận dụng tính chất này, người ta áp dụng nguyên tắc Pascal cho những máy nén thủy lực.
Xem thêm: Định luật Pascal
Hình học của phân tử nước
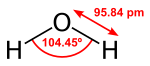
Phân tử nước gồm có hai nguyên tử hydrogen và một nguyên tử oxygen. Về mặt hình học thì phân tử nước có góc link là 104,45°. Do những cặp điện tử tự do chiếm nhiều chỗ nên góc này sai lệch đi so với góc lý tưởng của hình tứ diện. Chiều dài của link O-H là 95,84 picômét.
Tính lưỡng cực
Tính lưỡng cực
Oxygen có độ âm điện cao hơn hydrogen. Việc cấu trúc thành hình ba góc và việc tích điện từng phần rất khác nhau của những nguyên tử đã dẫn đến cực tính dương ở những nguyên tử hydrogen và cực tính âm ở nguyên tử oxygen, gây ra sự lưỡng cực. Dựa trên hai cặp điện tử đơn độc của nguyên tử oxygen, lý thuyết VSEPR đã lý giải sự sắp xếp thành góc của hai nguyên tử hydrogen, việc tạo thành moment lưỡng cực và vì vậy mà nước có những tính chất đặc biệt. Vì phân tử nước có tích điện từng phần rất khác nhau nên một số trong những sóng điện từ nhất định như sóng cực ngắn hoàn toàn có thể làm cho những phân tử nước xấp xỉ, dẫn đến việc nước được đun nóng. Hiện tượng này được áp dụng để sản xuất lò vi sóng.
Liên kết hiđrô
Các phân tử nước tương tác lẫn nhau thông qua link hydrogen và nhờ vậy có lực hút phân tử lớn. Đây không phải là một link bền vững. Liên kết của những phân tử nước thông qua link hiđrô chỉ tồn tại trong một phần nhỏ của một giây, sau đó những phân tử nước tách ra khỏi link này và link với những phân tử nước khác.
Phân tử nước
Đường kính nhỏ của nguyên tử hydrogen đóng vai trò quan trọng cho việc tạo thành những link hydrogen, chính bới chỉ có như vậy nguyên tử hydrogen mới hoàn toàn có thể đến gần nguyên tử oxygen một chừng mực đầy đủ. Các chất tương đương của nước, Ví dụ như acid sulfuric (H2S), không tạo thành những link tương tự vì hiệu số điện tích quá nhỏ Một trong những phần link. Việc tạo chuỗi của những phân tử nước thông qua link cầu nối hydrogen là nguyên nhân cho nhiều tính chất đặc biệt của nước, ví dụ như nước tuy nhiên có khối lượng mol nhỏ vào khoảng chừng 18 g/mol vẫn ở thể lỏng trong điều kiện tiêu chuẩn. trái lại, H2S tồn tại ở dạng khí cùng ở trong những điều kiện này. Nước có khối lượng riêng lớn số 1 ở 4 độ Celcius và nhờ vào đó mà băng đá hoàn toàn có thể nổi lên trên mặt nước; hiện tượng kỳ lạ này được lý giải nhờ vào link cầu nối hiđrô.
Liên kết hiđrô
Cấu tạo của phân tử nước tạo nên những link hiđrô Một trong những phân tử là cơ sở cho nhiều tính chất của nước. Cho đến nay một số trong những tính chất của nước vẫn còn là một câu đố cho những nhà nghiên cứu và phân tích tuy nhiên nước đã được nghiên cứu và phân tích từ lâu.
Nhiệt độ nóng chảy và nhiệt độ sôi của nước đã được Anders Celsius dùng làm hai điểm mốc cho độ bách phân Celcius. Cụ thể, nhiệt độ đóng băng của nước là 0 độ Celcius, còn nhiệt độ sôi (760 mmHg) bằng 100 độ Celcius. Nước đóng băng được gọi là nước đá. Nước đã hóa hơi được gọi là hơi nước. Nước có nhiệt độ sôi tương đối cao nhờ link hiđrô.
Dưới áp suất thông thường nước có khối lượng riêng (tỷ trọng) cao nhất là ở 4 °C: 1 g/cm³ đó là vì nước vẫn tiếp tục giãn nở khi nhiệt độ hạ xuống dưới 4 °C. Điều này sẽ không được quan sát ở bất kỳ một chất nào khác. Điều này nghĩa là: Với nhiệt độ trên 4 °C, nước có đặc tính giống mọi vật khác là nóng nở, lạnh co; tuy nhiên với nhiệt độ dưới 4 °C, nước lại lạnh nở, nóng co. Do hình thể đặc biệt của phân tử nước ( với góc link 104,45° ), khi bị làm lạnh những phân tử phải dời xa ra để tạo link tinh thể lục giác mở. Vì vậy mà tỉ trọng của nước đá nhẹ hơn nước thể lỏng.[11]
Khi đông lạnh dưới 4 °C, những phân tử nước phải dời xa ra để tạo link tinh thể lục giác mở.
Nước là một dung môi tốt nhờ vào tính lưỡng cực. Các hợp chất phân cực hoặc có tính ion như acid, rượu và muối đều dễ tan trong nước. Tính hòa tan của nước đóng vai trò rất quan trọng trong sinh học vì nhiều phản ứng hóa sinh chỉ xảy ra trong dung dịch nước.
Nước tinh khiết không dẫn điện. Mặc dù vậy, do có tính hòa tan tốt, nước hay có tạp chất pha lẫn, thường là những muối, tạo ra những ion tự do trong dung dịch nước được cho phép dòng điện chạy qua.
Về mặt hóa học, nước là một chất lưỡng tính, hoàn toàn có thể phản ứng như một, hoàn toàn có thể hiểu đơn giản khi một oxide acid hoặc một oxide base tác dụng với nước sẽ tạo ra dung dịch acid hay base tương ứng. Ở 7 pH (trung tính) hàm lượng những ion hydroxyt (OH-) cân đối với hàm lượng của hydronium (H3O+). Khi phản ứng với một axit mạnh hơn ví dụ như HCl, nước phản ứng như một chất kiềm:
HCl + H2O ↔ H3O+ + Cl-Với ammoniac nước lại phản ứng như một axit:
NH3 + H2O ↔ NH4+ + OH-Trong công nghiệp, nước hoàn toàn có thể hóa lỏng bằng phương pháp làm tan băng đá, hoặc lọc từ nước biển và những nguồn nước không tinh khiết bằng những phương pháp rất khác nhau như lọc, chiết, tách, chưng cất (Chưng cất là một phương pháp tách dùng nhiệt để tách hỗn hợp đồng thể của những chất lỏng rất khác nhau. Chất rắn hòa tan, ví dụ như nhiều chủng loại muối, được tách ra khỏi chất lỏng bằng phương pháp kết tinh. Dung dịch muối hoàn toàn có thể làm cô đặc bằng phương pháp cho bay hơi), bốc hơi nước,... có sự phối hợp của ngưng tụ.
Trong phòng thí nghiệm
Chủ yếu người ta dùng cách cho H 2 displaystyle ce H2 tác dụng với O 2 displaystyle ce O2 để xảy ra phản ứng hóa hợp tạo nước nhưng nguy hiểm vì nó phát nổ, khi tỉ lệ H:O là 2:1 thì hỗn hợp nổ mạnh nhất. Ta có phương trình điều chế nước như sau:
2 H 2 + O 2 → t e m p e r a t u r e 2 H 2 O displaystyle ce 2H2 + O2 ->[temperature] 2H2O
Trong sinh hoạt
Hiện nay nguồn nước mà người dân sử dụng trong sinh hoạt hằng ngày thường được lấy từ: Hệ thống đáp ứng nước tập trung (nước máy), nước mưa, nước giếng khơi, nước máng lần, nước giếng khoan…
Ở đây có ba trạng thái tập hợp của nước cạnh nhau: tảng băng ở thể rắn, hồ nước ở thể lỏng và hơi nước ở thể khí.
Sự sống trên Trái Đất bắt nguồn từ trong nước. Tất cả những dạng sống trên Trái Đất đều phụ thuộc vào nước và vòng tuần hoàn nước.
Nước có ảnh hưởng quyết định đến khí hậu và là nguyên tự tạo ra thời tiết. Năng lượng mặt trời sưởi ấm không đồng đều những đại dương đã tạo nên những dòng hải lưu trên toàn cầu. Dòng hải lưu Gulf Stream vận chuyển nước ấm từ vùng Vịnh Mexico đến Bắc Đại Tây Dương làm ảnh hưởng đến khí hậu của vài vùng châu Âu.
Nước là thành phần quan trọng của những tế bào sinh học và là môi trường tự nhiên thiên nhiên của những quá trình sinh hóa cơ bản như quang hợp.
Hơn 75% diện tích s quy hoạnh của Trái Đất được bao trùm bởi nước. Lượng nước trên Trái Đất có vào khoảng chừng 1,38 tỉ km³. Trong số đó 97,4% là nước mặn trong những đại dương trên thế giới, phần còn sót lại, 2,6%, là nước ngọt, tồn tại đa phần dưới dạng băng tuyết đóng ở hai cực và trên những ngọn núi, chỉ có 0,3% nước trên toàn thế giới (hay 3,6 triệu km³) là hoàn toàn có thể sử dụng làm nước uống. Việc đáp ứng nước uống sẽ là một trong những thử thách lớn số 1 của loài người trong vài thập niên tới đây. Nguồn nước đã và đang là nguyên nhân gây ra một trong những cuộc trận chiến tranh ở Trung Cận Đông.
Nước được sử dụng trong công nghiệp từ lâu như thể nguồn nhiên liệu (cối xay nước, máy hơi nước, nhà máy sản xuất thủy điện) như thể chất trao đổi nhiệt.
Nhà triết học người Hy Lạp Empedocles đã coi nước là một trong bốn nguồn gốc tạo ra vật chất (cạnh bên lửa, đất và không khí). Nước cũng nằm trong Ngũ Hành của triết học cổ Trung Hoa.
Với tình trạng ô nhiễm ngày một nặng và dân số ngày càng tăng, nước sạch dự báo sẽ sớm trở thành một thứ tài nguyên quý giá không kém dầu mỏ trong thế kỷ trước. Nhưng không như dầu mỏ hoàn toàn có thể thay thế bằng nhiều chủng loại nhiên liệu khác ví như điện, nhiên liệu sinh học, khí đốt..., nước không thể thay thế và trên thế giới tất cả những dân tộc bản địa đều cần đến nó để bảo vệ môi trường tự nhiên thiên nhiên sống đời thường của tớ, cho nên vì thế vấn đề nước trở thành chủ đề quan trọng trên những hội đàm quốc tế và những xích míc về nguồn nước đã được dự báo trong tương lai. Tuy nhiên mới gần đây người ta đã lọc được nước biển từ một thiết bị lọc rẻ tiền và từ đó xử lý và xử lý được vấn đề thiếu nước.
- Chiến tranh nước
Nước uống
Nước ngọt
- OA Jones, JN Lester and N Voulvoulis, Pharmaceuticals: a threat to drinking water? TRENDS in Biotechnology 23(4): 163, 2005
Franks, F (Ed), Water, A comprehensive treatise, Plenum Press, Tp New York, 1972-1982
PH Gleick and associates, The World's Water: The Biennial Report on Freshwater Resources. Island Press, Washington, D.C. (published every two years, beginning in 1998.)
Marks, William E., The Holy Order of Water: Healing Earth's Waters and Ourselves. Bell Pond Books (a div. of Steiner Books), Great Barrington, MA, November 2001 [ISBN 0-88010-483-X]
Debenedetti, P. G., and Stanley, H. E.; "Supercooled and Glassy Water", Physics Today 56 (6), p. 40-46 (2003). Downloadable PDF (1.9 MB)
- Anderson (1991). Water Rights: Scarce Resource Allocation, Bureaucracy, and the Environment. ISBN 0884103900.
Maude Barlow, Tony Clarke (2003). Blue Gold: The Fight to Stop the Corporate Theft of the World's Water. ISBN 1565848136.
Gleick, Peter H. (2000). The World's Water: The Biennial Report on Freshwater Resources. Washington: Island Press. ISBN 1559637927.
Miriam R. Lowi (1995). Water and Power: The Politics of a Scarce Resource in the Jordan River Basin. ISBN 0521431646. (Cambridge Middle East Library)
William E. Marks (2001). The Holy Order of Water: Healing Earths Waters and Ourselves.
Postel, Sandra (1997, second edition). Last Oasis: Facing Water Scarcity. Tp New York: Norton Press. ISBN 0393034283. Kiểm tra giá trị ngày tháng trong: |year= (trợ giúp)
Reisner, Marc (1993). Cadillac Desert: The American West and Its Disappearing Water. ISBN 0670199273.
Vandana Shiva (2002). Water Wars: Privatization, Pollution, and Profit. London: Pluto Press [u.a.] ISBN 0-7453-1837-1. OCLC 231955339.
Anita Roddick; và đồng nghiệp (2004). Troubled Water: Saints, Sinners, Truth And Lies About The Global Water Crisis. ISBN 095439593X. “Và đồng nghiệp” được ghi trong: |author= (trợ giúp)
Marq de Villiers (2003, revised edition). Water: The Fate of Our Most Precious Resource. ISBN 0618030093. Kiểm tra giá trị ngày tháng trong: |year= (trợ giúp)
Diane Raines Ward (2002). Water Wars: Drought, Flood, Folly and the Politics of Thirst. ISBN 1573222291.
Worster, Donald (1992). Rivers of Empire: Water, Aridity, and the Growth of the American West. ISBN 039451680X.
^ Definition of Hydrol Merriam-Webster ^ a b Vienna Standard Mean Ocean Water (VSMOW), used for calibration, melts 273.1500089(10) K (0.000089(10) °C, and boils 373.1339 K (99.9839 °C). Other isotopic compositions melt or boil slightly different temperatures. ^ a b ://chemister.ru/Database/properties-en.php?dbid=1&id=1 ^ Thermal Conductivity of some common Materials. Engineeringtoolbox.com. Truy cập 2011-11-22 ^ “Water Q.&A: Why is water the "universal solvent"?”. www.usgs.gov. Truy cập ngày 15 tháng 1 năm 2022. ^ “10.2: Hybrid Orbitals in Water”. Chemistry LibreTexts (bằng tiếng Anh). 18 tháng 3 năm 2022. Truy cập ngày 11 tháng 4 năm 2022. ^ “CIA – The world factbook”. Central Intelligence Agency. Truy cập ngày 20 tháng 12 năm 2008. ^ Gleick, P.H. sửa đổi và biên tập (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. tr. 13, Table 2.1 "Water reserves on the earth". Bản gốc tàng trữ ngày 8 tháng 4 năm 2013. ^ Water Vapor in the Climate System Lưu trữ 2007-03-20 tại Wayback Machine, Special Report, [AGU], December 1995 (linked 4/2007). Vital Water Lưu trữ 2008-02-20 tại Wayback Machine UNEP. ^ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007). “Evaluating the environmental impact of various dietary patterns combined with different food production systems”. European Journal of Clinical Nutrition. 61 (2): 279–286. doi:10.1038/sj.ejcn.1602522. PMID 17035955. ^ The Expansion of Water Upon Freezing hyperphysics.phy-astr.gsu.edu
- Phương tiện liên quan tới Water tại Wikimedia Commons
Nước tại Từ điển bách khoa Việt Nam
Water tại Encyclopædia Britannica (tiếng Anh)
