Thủ Thuật Hướng dẫn Điện tích lớp vỏ là gì Chi Tiết
Dương Thế Tùng đang tìm kiếm từ khóa Điện tích lớp vỏ là gì được Cập Nhật vào lúc : 2022-12-16 19:28:06 . Với phương châm chia sẻ Kinh Nghiệm Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read tài liệu vẫn ko hiểu thì hoàn toàn có thể lại phản hồi ở cuối bài để Admin lý giải và hướng dẫn lại nha.Cấu tạo vỏ nguyên tử là nội dung quan trọng trong chương trình Hóa học lớp 10. Team Marathon Education đã tổng hợp những lý thuyết về cấu trúc vỏ nguyên tử, những lớp electron, những bài tập vận dụng có lời giải rõ ràng và chia sẻ đến những em qua nội dung bài viết sau. Các em hãy theo dõi nội dung bài viết nhé!
Nội dung chính Show- Lý thuyết cấu trúc vỏ nguyên tửKhái niệm nguyên tửThành phần cấu trúc nên nguyên tửSự hoạt động và sinh hoạt giải trí của những electron trong nguyên tửObitan nguyên tửObitan nguyên tử là gì?Obitan nguyên tử có những hình dạng nào?Lớp electron và phân lớp electron trong cấu trúc vỏ nguyên tửLớp electronPhân lớp electronSố electron tối đa trong cấu trúc vỏ nguyên tửSố electron tối đa trong phân lớpSố electron tối đa trên mỗi lớpBài tập về cấu trúc vỏ nguyên tửBài 1 Trang 22 SGK Hóa 10Bài 2 Trang 22 SGK Hóa 10Bài 3 Trang 22 SGK Hóa 10Bài 4 Trang 22 SGK Hóa 10Bài 5 Trang 22 SGK Hóa 10Bài 6 Trang 22 SGK Hóa 10Lớp vỏ mang điện tích gì?Lớp vỏ electron là gì?Diện tích của electron là bao nhiêu?Xác định diện tích s quy hoạnh hạt nhân là gì?
>>> Xem thêm: Lý Thuyết Và Cách Học Thuộc Nhanh Bảng Tuần Hoàn Hóa Học Lớp 10
Lý thuyết cấu trúc vỏ nguyên tử
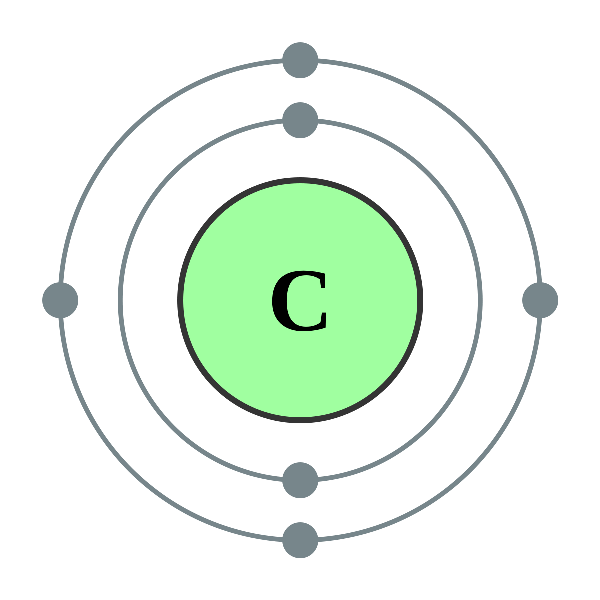 Lý thuyết cấu trúc vỏ nguyên tử với cấu trúc vỏ nguyên tử của nguyên tố cacbon (Nguồn: Internet)
Lý thuyết cấu trúc vỏ nguyên tử với cấu trúc vỏ nguyên tử của nguyên tố cacbon (Nguồn: Internet)Khái niệm nguyên tử
Nguyên tử là những hạt có kích thước vô cùng nhỏ. Những hạt này trung hoà về điện và hoàn toàn có thể tạo nên những chất và những nguyên tố hoá học.
Thành phần cấu trúc nên nguyên tử
Nguyên tử cấu trúc từ vỏ nguyên tử và hạt nhân.
- Cấu tạo vỏ nguyên tử gồm có những electron mang điện tích âm. Hạt nhân gồm có những hạt proton và notron. Hạt nhân nằm giữa nguyên tử và có điện tích dương.Số electron có trong vỏ nguyên tử = số proton có trong hạt nhân = Z
>>> Xem thêm: Lý Thuyết Hóa 10: Thành Phần Nguyên Tử, Kích Thước Và Khối Lượng
Sự hoạt động và sinh hoạt giải trí của những electron trong nguyên tử
Các electron hoạt động và sinh hoạt giải trí rất nhanh xung quanh hạt nhân nguyên tử. Chúng tạo thành một đám mây electron và không theo những quỹ đạo xác định.
>>> Xem thêm: Hạt Nhân Nguyên Tử Là Gì? Cấu Tạo Của Hạt Nhân Nguyên Tử

Obitan nguyên tử
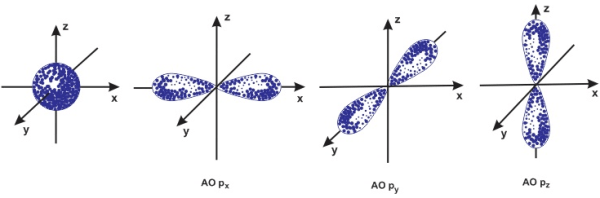 Obitan nguyên tử là gì? (Nguồn: Internet)
Obitan nguyên tử là gì? (Nguồn: Internet)Obitan nguyên tử là gì?
Obitan nguyên tử là khu vực đám mây electron nằm xung quanh hạt nhân mà ở đó xác suất xuất hiện electron là lớn số 1 (90%). Obitan nguyên tử có kí hiệu là AO.
Obitan nguyên tử có những hình dạng nào?
Obitan nguyên tử có 2 hình dạng phổ biến là:
- Obitan s: có dạng hình cầuObitan p: gồm 3 obitan px, py và pz định hướng lần lượt theo những trục Ox, Oy, Oz. Obitan p có dạng số 8 nổi.
Lớp electron và phân lớp electron trong cấu trúc vỏ nguyên tử
Lớp electron
Lớp electron gồm có những electron có những mức năng lượng gần bằng với nhau.
Ở bảng phía dưới, những electron nguyên tử có những mức năng lượng từ thấp đến cao (từ gần hạt nhân đến xa hạt nhân). Chúng được xếp thành 7 lớp electron.
Mức năng lượng n1234567Tên lớpKLMNOPQCó số obitan là n214916Có số electron tối đa là 2n2281832Phân lớp electron
Mỗi lớp electron được chia tiếp thành những phân lớp nhỏ hơn.
Phân lớp electron có những tính chất như sau:
- Phân lớp electron gồm có những electron có mức năng lượng bằng nhau.4 phân lớp được kí hiệu bằng những vần âm s, p, d, f.Số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó. Ví dụ:
- Lớp thứ nhất (n = 1) có một phân lớp: 1s.Lớp thứ hai (n = 2) có 2 phân lớp: 2s, 2p.Lớp thứ ba (n = 3) có 3 phân lớp: 3s, 3p, 3d.
>>> Xem thêm: Lý Thuyết Và Cách Viết Cấu Hình Electron Nguyên Tử
Số electron tối đa trong cấu trúc vỏ nguyên tử
Số electron tối đa trong phân lớp
Phân lớpspdfSố e tối đa trong 1 phân lớp (Số e tối đa = Số AO x 2)261014Cách viếts2p6d10f14Phân lớp electron bão hoà là phân lớp đã có đủ số electron đối đa.
Số electron tối đa trên mỗi lớp
Từ phân lớp đã nêu trên ta hoàn toàn có thể suy ra số electron tối đa trong một lớp :
Lớp electronCác phân lớp electron trong mỗi lớpSố e tối đa của từng lớpLớp K (n =1)1s22Lớp L (n =2)2s22p62 + 6 = 8Lớp M (n =3)3s23p63d102 + 6 + 10 = 18Lớp N (n = 4)4s24p64d104f142 + 6 + 10 + 14 = 32Bài tập về cấu trúc vỏ nguyên tử
Bài 1 Trang 22 SGK Hóa 10
beginaligned & small textMột nguyên tử M có 75 electron và 110 notron. Kí hiệu của nguyên tử M là: \ & small A. ^185_75M \ & small B. ^75_185M \ & small C. ^110_75M \ & small D. ^75_110M endalignedHướng dẫn:
beginaligned & small textSố khối của nguyên tử M: A = Z + N = 75 + 110 = 185 \ & small textKí hiệu của nguyên tử M sẽ có dạng tổng quát là ^A_ZM \ & small textVậy ta chọn đáp án A. ^185_75M. endalignedBài 2 Trang 22 SGK Hóa 10
beginaligned & small textNguyên tử nào trong những nguyên tử sau đây chứa đồng thời 20 notron, 19 proton và 19 electron? \ & small A. ^37_17Cl \ & small B. ^39_19K \ & small C. ^40_18Ar \ & small D. ^40_19K endalignedHướng dẫn:
beginaligned & small textTheo đề bài, nguyên tử sau chứa đồng thời 20 notron, 19 proton và 19 electron \ & small implies Z = P = E = 19 \ & small implies A = Z + N = 19 + 20 = 39 \ & small textVậy ta chọn đáp án B. ^39_19K. endalignedBài 3 Trang 22 SGK Hóa 10
Số đơn vị điện tích hạt nhân của nguyên tử flo là 9. Trong nguyên tử flo, số electron ở mức năng lượng cao nhất là:
A. 2
B. 5
C. 9
D. 11
Hướng dẫn:
Theo đề bài, số đơn vị điện tích hạt nhân của nguyên tử flo là 9 nên nguyên tử flo có 9 electron phân bố vào những phân lớp như sau 1s22s22p5.
Do đó, flo có 5 electron ở mức năng lượng cao nhất. Vậy ta chọn đáp án B.
Bài 4 Trang 22 SGK Hóa 10
Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử X là:
A. 6
B. 8
C. 14
D. 16
Hướng dẫn:
Theo đề bài, những electron của nguyên tử nguyên tố X được phân bố trên 3 mức năng lượng, lớp thứ 3 có 6 electron nên nguyên tử X có thông số kỹ thuật electron như sau 1s22s22p63s23p4.
Điện tích hạt nhân của nguyên tử X là Z = 2 + 2 + 6 + 2 + 4 = 16+. Vậy ta chọn đáp án D.
Bài 5 Trang 22 SGK Hóa 10
a. Thế nào là lớp và phân lớp electron ? Sự rất khác nhau giữa lớp và phân lớp electron?
b. Tại sao lớp N chứa tối đa 32 electron.
Hướng dẫn:
a.
Lớp electron là gồm những electron có năng lượng gần bằng nhau.
Phân lớp electron là gồm những electron có mức năng lượng bằng nhau.
Sự rất khác nhau giữa lớp và phân lớp electron thể hiện ở điểm lớp thì gồm những electron có năng lượng gần bằng nhau còn phân lớp thì những electron có năng lượng bằng nhau.
b.
Lớp N là lớp thứ 4 có những phân lớp s, p, d, f có số electron tối đa tương ứng những phân lớp là 2, 6, 10, 14 (1s22s22p63s23p44s24p64d104f14) nên có số electron tối đa là 2 + 6 + 10 + 14 = 32.
Bài 6 Trang 22 SGK Hóa 10
beginaligned & small textNguyên tử agon có kí hiệu là ^40_18Ag \ & small texta. Hãy xác định số proton, số proton trong hạt nhân và số electron ở vỏ electron của nguyên tử. \ & small textb. Hãy xác định sự phân bố electron trên những lớp. endalignedHướng dẫn:
beginaligned & small texta. Từ kí hiệu nguyên tử ^40_18Ag \ & small implies Z = P = E = 18 text và N = A - Z = 40 - 18 = 22 \ & small textb. Sự phân bố của 18 electron trên lớp vỏ nguyên tử agon như sau 1s^22s^22p^63s^23p^6. endalignedTham khảo ngay những khoá học online của Marathon Education
Với những lý thuyết cấu trúc vỏ nguyên tử Hóa 10 mà Team Marathon Education đã chia sẻ qua nội dung bài viết trên, kỳ vọng những em hoàn toàn có thể làm rõ hơn về nội dung này và biết phương pháp giải những bài tập về cấu trúc vỏ nguyên tử. Các em hãy truy cập vào website của Marathon thường xuyên để học trực tuyến nhiều kiến thức và kỹ năng Toán – Lý Hóa – Văn có ích khác nhé! Chúc những em học tập tốt và luôn đạt điểm cao!
Lớp vỏ mang điện tích gì?
Vỏ nguyên tử Electron. Electron là hạt vỏ nguyên tử mang điện tích âm, hạt này sẽ hút điện về phía những proton có điện tích dương. Các hạt electron xung quanh nguyên tử gọi là orbital, những orbital vây xung quang nguyên tử dạng hình cầu, còn những orbital bên phía ngoài có cấu trúc phức tạp hơn.Lớp vỏ electron là gì?
Trong hóa học và vật lý nguyên tử, vỏ electron, lớp electron hoặc mức năng lượng chính, hoàn toàn có thể được xem là một quỹ đạo theo sau là những electron xung quanh hạt nhân của nguyên tử.Diện tích của electron là bao nhiêu?
Nguyên tử gồm một hạt nhân (mang điện tích dương) và những electrôn (mang điện tích âm) quay quanh hạt nhân.Xác định diện tích s quy hoạnh hạt nhân là gì?
- Cách xác định điện tích hạt nhân nguyên tử: Hạt nhân có Z proton thì điện tích hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z. Trong số đó: + Z là số đơn vị điện tích hạt nhân. + E là tổng số electron có trong nguyên tử. Tải thêm tài liệu liên quan đến nội dung bài viết Điện tích lớp vỏ là gì