Thủ Thuật Hướng dẫn Đánh giá hóa học lớp 8 bài 19 Chi Tiết
Bùi Thành Tài đang tìm kiếm từ khóa Đánh giá hóa học lớp 8 bài 19 được Update vào lúc : 2022-12-21 01:28:04 . Với phương châm chia sẻ Kinh Nghiệm về trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Admin lý giải và hướng dẫn lại nha.Trước thềm năm học mới, việc soạn bài cho bộ môn mình đảm trách của những thầy cô giáo trở nên thiết yếu hơn bao giờ hết. Vì thế, Tip.edu đã sưu tầm và đăng tải Giáo án Hóa học 8 bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất (Tiết 1) dành riêng cho quý thầy cô cùng tham khảo.
Bài 19. CHUYỂN ĐỔI GIỮA KHỐI LƯỢNG, THỂ TÍCH VÀ LƯỢNG CHẤT (T1)
I. MỤC TIÊU: Sau tiết này HS phải:
1. Kiến thức: Biết được:
- Biểu thức màn biểu diễn mối liên hệ giữa lượng chất (n), khối lượng (m).
2. Kĩ năng:
- Tính được m (hoặc n) của chất lúc biết những đại lượng có liên quan.
3. Thái độ:
- Hình thành cho HS hứng thú trong học tập.
4. Trọng tâm:
- Biết cách quy đổi giữa mol, khối lượng của chất.
5. Năng lực cần hướng tới:
- Năng lực sử dụng ngôn từ hóa học, năng lực xử lý và xử lý vấn đề thông qua môn hóa học, năng lực vận dụng kiến thức và kỹ năng hóa học vào môi trường tự nhiên thiên nhiên sống đời thường, năng lực tính toán.
II. CHUẨN BỊ:
1. Giáo viên – học viên:
a. GV: Bài tập vận dụng.
b. HS: Đọc trước bài ở nhà.
2. Phương pháp:
Đàm thoại – thảo luận nhóm – thao tác thành viên.
III. CÁC HOẠT ĐỘNG DẠY VÀ HỌC:
1. Ổn định lớp (1’):
Lớp
Sĩ số
Tên học viên vắng
8A1
……………..
……………………………………
8A5
……………..
……………………………………
8A6
……………..
……………………………………
2. Kiểm tra bài cũ (5’):
HS1: Mol là gì? Khối lượng mol là gì? Áp dụng tính khối lượng mol H2O.
HS2: Nêu khái niệm thể tích mol của chất khí? Tính thể tích (ở đktc ) của: 0,5 mol H2.
3. Bài mới:
a. Giới thiệu bài: (1’)
Trong thực tế ta thường hay thay đổi số lượng thành khối lượng và nguợc lại. Trong tính toán hoá học cũng vậy, tất cả chúng ta phải thường xuyên quy đổi giữa lượng chất (số mol) và khối lượng chất (m). Vậy cách quy đổi ra làm sao?
Bài 5 trang 67 sgk hóa học 8: Có 100 g khí oxi và 100 g khí cacbon đioxit, cả hai khí đều ở 200C và 1 atm. Biết rằng thể tích mol khí ở những điều kiện này là 24 l. Nếu trộn 2 khối lượng khí trên với nhau (không còn phản ứng xảy ra) thì hỗn hợp khí thu được hoàn toàn có thể tích là bao nhiêu ?
- Công thức quy đổi giữa lượng chất và khối lượng: n=mM
- Thể tích mol khí ở 20oC và 1 atm là 24 l. Nghĩa là một trong mol chất khí ở 20oC và 1 atm hoàn toàn có thể tích là 24l
nên với n mol khí ta hoàn toàn có thể tích: V = n.24 (l)
nO2=mO2MO2=10032=3,125mol→VO2=nO2.24=3,125.24=75(l)
nCO2=mCO2MCO2=10044=2511mol→VCO2=nCO2.24=2511.24=60011(l)
→Vhh=VO2+VCO2=75+60011=142511(l)≈129,55(l)
Bài 6 trang 67 sgk hóa học 8: Hãy vẽ những hình khối chữ nhật để so sánh thể tích những khí sau (đktc) :
1g H2 ; 8 g O2 ;
3,5 g N2 ; 33 g CO2.
Lời giải:- Bước 1: Tính số mol của những khí ở điều kiện tiêu chuẩn
- Bước 2: Tính thể tích những khí ở điều kiện tiêu chuẩn V = n x 22,4
- Bước 3: Vẽ những hình khối chữ nhật qua đồ thị thể hiện thể tích những khí ( có 2 cạnh đáy bằng 1, độ cao bằng thể tích của khí)
- Bước 4: So sánh
Ta có số mol của những khí ở điều kiện tiêu chuẩn là:
nH2=mH2MH2=12=0,5mol
nO2=mO2MO2=832=0,25mol
nN2=mN2MN2=3,528=0,125mol
nCO2=mCO2MCO2=3344=0,75mol
Bảng thể tích những khí ở điều kiện tiêu chuẩn:
Khí
H2
O2
N2
CO2
n (mol)
0,5
0,25
0,125
0,75
V (l)
11,2
5,6
2,8
16,8
Từ đó ta vẽ được đồ thị so sánh thể tích những khí:

Tỷ lệ số mol những chất khí cũng đó đó là tỷ lệ về thể tích những khí nên thể tích khí VCO2>VH2>VO2>VN2
Lý thuyết Chuyển đổi giữa khối lượng thể tích và lượng chất
1. Chuyển đổi giữa lượng chất và khối lượng chất
Ví dụ: Tính khối lượng của 0,25 mol CO2? Biết khối lượng mol của CO2 là 44 g/mol
Hướng dẫn:
Khối lượng của 0,25 mol CO2 là :
Ta biết: 1 mol phân tử CO2 có khối lượng 44 gam
=> 0,25 mol phân tử CO2 có khối lượng x gam
=> x = 0,25.44 = 11 gam hay

* Công thức: m = n.M (gam)
Trong số đó: n là số mol chất (mol)
M là khối lượng mol chất (g/mol)
m là khối lượng chất (gam)
Ta có 2 công thức liên quan sau: và
2. Chuyển đổi giữa lượng chất và thể tích chất khí
Ví dụ: 0,25 mol khí CO2 ở điều kiện tiêu chuẩn hoàn toàn có thể tích là bao nhiêu lít?
Hướng dẫn:
1 mol khí ở điều kiện tiêu chuẩn chiếm 22,4 lít
=> 0,25 mol ở điều kiện tiêu chuẩn chiếm: 0,25.22,4 = 5,6 lít
* Công thức: V = n.22,4 (lít)
Trong số đó: n là số mol chất (mol)
V : Thể tích chất ở điều kiện tiêu chuẩn (lít)
Ta có công thức liên quan:
Sơ đồ tư duy: Chuyển đổi giữa khối lượng thể tích và lượng chất.
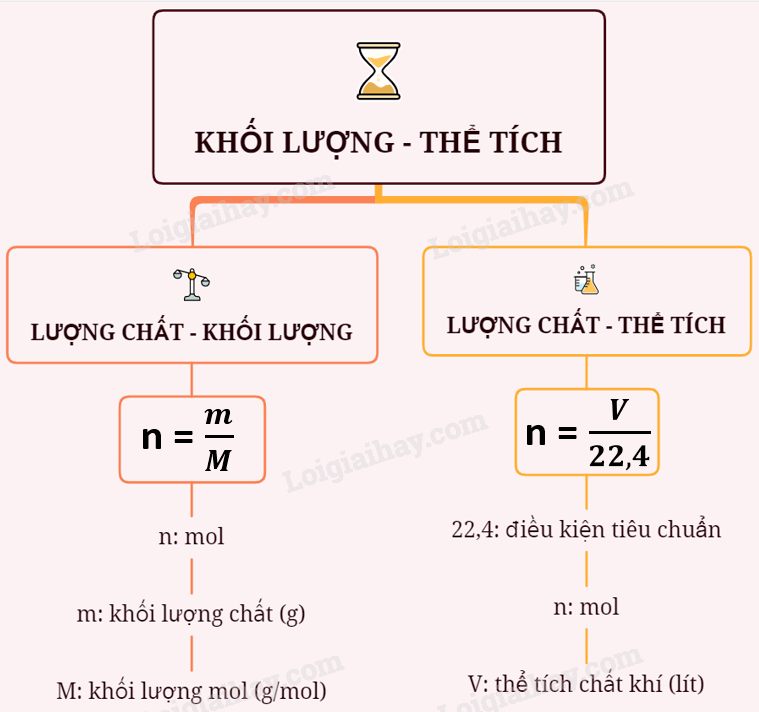
Phương pháp giải một số trong những dạng bài tập về sự quy đổi giữa khối lượng, thể tích và lượng chất
Dạng 1: Bài toán về sự quy đổi giữa số mol (n) và khối lượng (m)
Một số lưu ý cần nhớ:
Ta có công thức :
n = m : M
n : số mol
m : Khối lượng
M : Khối lượng mol
* Một số ví dụ điển hình:
Ví dụ 1: a, Tính số mol của 28 gam Fe; 60 gam Mg
b, Tính tổng số mol có trong hỗn hợp khí sau: 0,44 gam CO2; 0,04 gam H2; 0,56 gam N2
Lời giải:
a, n Fe = m : M = 28 : 56 = 0,5 mol
n Mg = m : M = 60: 24 = 2,5 mol
b, n CO2 = m : M = 0,44 : 44 = 0,01 mol
n H2 = 0,04 : 2 = 0,02 mol
n N2 = 0,56 : 28 = 0,02 mol
=> Tổng số mol khí có trong hỗn hợp X là:
0,01 + 0,02 + 0,02 = 0,05 mol
Ví dụ 2: Trong một binh trộn khí SO2 và SO3. Khi phân tích người ta thấy có 2,4 gam S và 2,8 gam oxi. Xác định tỉ số mol SO2 và SO3 trong bình sau khi trộn
Lời giải:
Gọi số mol SO2 là x => n S = x; n O = 2x
Gọi số mol SO3 là y => n S = y; n O = 3y
Ta có hệ phương trình:
(x + y) . 32 = 2,4
(2x + 3y) . 16 = 2,8
=> x = 0,05 ; y = 0,025
=> n SO2 : n SO3 = x : y = 0,05 : 0,025 = 2 :1
Ví dụ 3: Một hỗn hợp khí chứa 0,25 mol SO2; 0,15 mol khí CO2; 0,65 mol khí N2 và 0,45 mol khí H2
Tính khối lượng của hỗn hợp khí X trên
Lời giải:
Khối lượng của khí SO2 là:
m SO2 = n . M = 0,25 . 64 = 16 gam
Khối lượng của khí CO2 là:
m CO2 = n . M = 0,15 . 44 = 6,6 gam
Khối lượng của khí N2 là:
m N2 = n . M = 0,65 . 28 = 18,2 gam
Khối lượng của khí H2 là:
n H2 = n . M = 0,45 . 2 = 0,9 gam
=> Tổng khối lượng của hỗn hợp khí X là:
16 + 6,6 + 18,2 + 0,9 = 41,7 gam
Dạng 2: Bài toán về sự quy đổi giữa số mol (n) và thể tích (V)
* Một số lưu ý cần nhớ:
Xét khí ở điều kiện tiêu chuẩn ta có công thức như sau:
n = V : 22,4 (mol)
n : Số mol
V : Thể tích khí ở đktc
* Một số ví dụ điển hình
Ví dụ 1: Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
Lời giải:
Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
V = (0,5 +0,2).22,4 =15,68 lít
Ví dụ 2: Tính thể tích của những khí và hỗn hợp khí sau đây:
a, 0,05 mol khí SO2
b, Hỗn hợp khí X: 0,1 mol H2; 0,15 mol SO2; 0,2 mol CO2
Lời giải:
a, V SO2 = n . 22,4 = 0,05 . 22,4 = 1,12 lít
b, Thể tích của hỗn hợp khí X là:
(0,1 + 0,15 + 0,2) . 22,4 = 10,08 lít
Dạng 3: Bài toán về sự quy đổi giữa khối lượng (m) và thể tích (V)
* Một số lưu ý cần nhớ:
Nhớ lại 2 công thức tính quen thuộc:
n = m : M
n = V : 22,4 (công thức này áp dụng cho chất khí ở đktc)
Đối với dạng toán này, ta cần đổi số liệu đề bài cho ra n (mol) rồi sau đó mới tính toán theo yêu cầu của đề bài
Tải thêm tài liệu liên quan đến nội dung bài viết Đánh giá hóa học lớp 8 bài 19