Thủ Thuật về Thể tích khí etilen cần dùng để phản ứng hết với 500 ml dung dịch brom 0 3 m là Chi Tiết
Họ và tên học viên đang tìm kiếm từ khóa Thể tích khí etilen cần dùng để phản ứng hết với 500 ml dung dịch brom 0 3 m là được Cập Nhật vào lúc : 2022-03-25 16:17:06 . Với phương châm chia sẻ Bí quyết Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi đọc Post vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Mình lý giải và hướng dẫn lại nha.
2 trả lời

2 trả lời

2 trả lời

2 trả lời

1 trả lời

2 trả lời

1 trả lời
Đề bài
Biết rằng 0,1 lít khí etilen (đktc) làm mất đi màu tối đa 50 ml dung dịch brom. Nếu dùng 0,1 lít khí axetilen (đktc) thì hoàn toàn có thể làm mất đi màu tối đa bao nhiêu ml dung dịch brom trên?
Video hướng dẫn giải
[embed]https://www.youtube.com/watch?v=CmgstzrBA8I[/embed]
Phương pháp giải - Xem rõ ràng
1 mol etilen hoàn toàn có thể phản ứng với tối đa 1 mol brom
1 mol axetilen hoàn toàn có thể làm mất đi màu tối đa 2 mol brom
Vậy lượng brom mà axetilen phản ứng gấp 2 lần so với etilen.
Lời giải rõ ràng
PTHH: CH2=CH2 + Br2 → C2H4Br2 (1)
CH≡CH + 2Br2 → Br2CH-CHBr2 (2)
Từ phương trình (1) và (2) ta nhận thấy (dfracn_C_2H_4n_Brmr_2 = dfrac11) và (dfracn_C_2H_2n_Brmr_2 = dfrac12)
( to) số mol brom phản ứng tối đa với C2H2 gấp 2 lần C2H4
=> Thể tích dung dịch brom cần khi phản ứng với C2H2 cũng gấp 2 lần khi phản ứng với C2H4
Vậy 0,1 lít C2H2 làm mất đi màu tối đa là 50 x 2 = 100ml dd brom
Loigiaihay.com
Giải Bài Tập Hóa Học 9 – Bài 38: Axetilen giúp HS giải bài tập, đáp ứng cho những em một khối mạng lưới hệ thống kiến thức và kỹ năng và hình thành thói quen học tập thao tác khoa học, làm nền tảng cho việc phát triển năng lực nhận thức, năng lực hành vi:
CH3 – CH3 ; CH≡ CH; CH2 = CH2; CH4; CH≡ C – CH3.
a) Chát nào có link ba trong phân tử?
b) Chất nào làm mất đi màu dung dịch brom?
Lời giải:
a) Có hai chất: CH≡ CH và CH≡ C – CH3 có link ba.
b) Có ba chất làm mất đi màu dung dịch brom: CH≡ CH; CH2 = CH2 và CH≡ C – CH3.
a) 0,224 lít etilen ở điều kiện tiêu chuẩn.
b) 0,224 lít axetilen ở điều kiện tiêu chuẩn.
Lời giải:
a)
C2H4 + Br2 → C2H4Br2
1 mol 1 mol 1 mol
0,01 mol ?
Theo pt: nBr2 = nC2H4 = 0,01 mol →
b)
С2H2 + 2Вr2 → C2H4Br2
1mol 2 mol 1 mol
0,01 mol ?
nBr2 = 2. nС2H2 = 0,02 (mol) →
Lời giải:
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2. (1)
C2H2 + 2Br2 → C2H2Br4. (2)
Từ phương trình (1) và (2) ta nhận thấy:
Tỉ lệ nC2H4 : nBr2 = 1:1
nC2H2 : nBr2 = 1:2
⇒ Số mol brom phản ứng tối đa với C2H2 gấp 2 lần C2H4 nên thể tích dung dịch brom cần dùng khi phản ứng với C2H2 cũng gấp 2 lần khi phản ứng với C2H4
VBr2 cần dung khi phản ứng với 0,1 l axeilen là: 50ml × 2 = 100ml.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất)
Lời giải:
a) PTHH:
Gọi a là số mol của CH4
Gọi b là số mol của C2H2
Ta có: nhh = a + b = 1,25 (∗)
Theo pt: (1) nO2 = 2. nCH4 = 2a mol
Theo pt (2) nO2 = 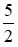 . nC2H2 =
. nC2H2 = 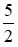 . b
. b
⇒ nO2 = 2a + 2,5b = 3 (∗∗)
Từ (∗) và (∗∗), ta giải hệ phương trình ta có: a = 0,25 (mol), b = 1 (mol)
nCH4 = 0,25 mol, nC2H2 = 1mol
VCH4 = 22,4. 0,25 = 5,6 (l)
b) nCO2 (1) = nCH4 = 0,25 (mol)
nCO2 (2) = 2. nC2H2 = 2 (mol)
VCO2 = (0,25 + 2). 22,4 = 50,4 (l).
a) Hãy viết phương trình hóa học.
b) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
Lời giải:
a) Phương trình hóa học:
C2H4 + Br2 → C2H4Br2 (1)
C2H2 + 2Br2 → C2H2Br4 (2)
Gọi nC2H4 = x mol, nC2H2 = y.
nhh khí = x + y = 0,025.
Theo pt: nB2(1) = nC2H4 = x mol, nBr2 (2) = 2. nC2H2= 2.y mol
⇒ nBr2 = x + 2y = 0,035.
b) Phần trăm thể tích mỗi khí:
Giải hệ phương trình ta có x = 0,015, y = 0,01.










