Mẹo về Hoàn thành những phương trình phản ứng sau: KMnO4 Chi Tiết
Dương Minh Dũng đang tìm kiếm từ khóa Hoàn thành những phương trình phản ứng sau: KMnO4 được Cập Nhật vào lúc : 2022-04-16 13:31:01 . Với phương châm chia sẻ Kinh Nghiệm Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read nội dung bài viết vẫn ko hiểu thì hoàn toàn có thể lại Comments ở cuối bài để Admin lý giải và hướng dẫn lại nha.Nếu chưa thấy hết, hãy kéo sang phải để thấy hết phương trình ==>
Nội dung chính- Hiện tượng nhận ra 2KMnO4 => MnO2 + O2 + K2MnO4Thông tin thêmMnO2 (Mangan oxit ) 1. Vai trò sinh học của oxi2. Ứng dụng của oxyK2MnO4 (kali manganat ) Hiện tượng nhận ra 2KNO3 => 2KNO2 + O2Thông tin thêmKNO2 (kali nitrit ) 1. Vai trò sinh học của oxi2. Ứng dụng của oxy1. Tài nguyên nước và quy trình nước toàn cầu2. Vai trò của nước3. Sự thật thú vị Vai trò sinh họcSự phong phú tự nhiênTrong y họcSản xuất hóa chấtNăng lượngKOH (kali hidroxit ) 1. Chất tẩy rửa2. Chất điện giải3. Công nghiệp thực phẩm4. Một số ứng dụng khácHiện tượng nhận ra 3N2 + 2O3 => 6NOPhân loại của phương trình Fe + CuSO4 => Cu + FeSO4Hiện tượng nhận ra Fe + CuSO4 => Cu + FeSO4Thông tin thêm Phương Trình Điều Chế Từ Fe Ra Cu Phương Trình Điều Chế Từ Fe Ra FeSO4 Phương Trình Điều Chế Từ CuSO4 Ra Cu Phương Trình Điều Chế Từ CuSO4 Ra FeSO4FeSO4 (Sắt(II) sunfat ) Bài Tập Trắc Nghiệm Liên QuanChuỗi Phương Trình Hóa Học Liên QuanPhân Loại Liên QuanVideo liên quan
Hãy kéo xuống dưới để xem điều kiện phản ứng
và Download Đề Cương Luyện Thi Miễn Phí
Xin hãy kéo xuống dưới để xem và thực hành những thắc mắc trắc nghiệm liên quan
☟☟☟
Phương Trình Hoá Học Lớp 8 Phương Trình Hoá Học Lớp 10 Phản ứng phân huỷ Phản ứng oxi-hoá khử Phản ứng nhiệt phân
Không tìm thấy thông tin về cách thực hiện phản ứng của phương trình 2KMnO4 => MnO2 + O2 + K2MnO4 Bạn tương hỗ update thông tin giúp chúng mình nhé!
Hiện tượng nhận ra 2KMnO4 => MnO2 + O2 + K2MnO4
Dung dịch Kali pemanganat (KMnO4) màu tím nhạt dần và xuất hiện kết tủa đen Mangat IV oxit (MnO2).
tin tức thêm
Khí oxi được điều chế bằng phương pháp phân huỷ những hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ KMnO4 (kali pemanganat) ra MnO2 (Mangan oxit)
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ KMnO4 (kali pemanganat) ra O2 (oxi)
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ KMnO4 (kali pemanganat) ra K2MnO4 (kali manganat)

Nhiệt phân KMnO4 để điều chế oxi trong phòng thí nghiệm theo phương trình hóa học sau: 2KMnO4 → K2MnO4 + MnO2 + O2 Dùng làm thuốc chữa bệnh cho cá. Được dùng trong Y học với tác dụng sát trùng. Kali pemanganat còn là một một chất oxi hóa mạnh, thí dụ tác dụng với toluen khi đun nóng: C6H5-CH3 + 2KMnO4 → C6H5-COOK + 2MnO2 + KOH + H2O • Chất hấp thụ khí gas – Chất oxi hóa của đường saccharin, vitamin C v.v… – Chất làm bay màu của tinh bột, vải dệt, chất béo
MnO2 (Mangan oxit )

Mangan(IV) oxit, thường gọi là mangan đioxit là một hợp chất vô cơ có công thức hóa học là MnO2. Hợp chất này là một chất rắn có màu đen hoặc nâu này tồn tại trong tự nhiên dưới dạng tài nguyên pyrolusite, cũng là một quặng chính của sắt kẽm kim loại mangan. Hợp chất này được sử dụng đa phần để sản xuất nhiều chủng loại pin tế bào khô, mà tiêu biểu là pin kiềm và pin kẽm-cacbon. MnO2 cũng khá được sử dụng làm chất tạo màu và là tiền thân của những hợp chất mangan khác, ví dụ như KMnO4. Nó còn được sử dụng làm chất xúc tác trong tổng hợp hữu cơ, ví dụ, trong quá trình oxy hóa rượu allylic. Thuốc màu Mangan đioxit, dưới dạng than non nâu, là một trong những hợp chất tự nhiên sớm nhất được tổ tiên của con người tiêu dùng. Nó được sử dụng như thể một sắc tố (màu), ít nhất là từ thời trung cổ. Hợp chất hoàn toàn có thể được sử dụng đầu tiên với mục tiêu dùng để sơn lên khung hình, sau đó áp dụng dần cho những bức tranh trong hang động. Một số bức tranh hang động nổi tiếng nhất ở châu Âu được thực hiện bằng phương pháp sử dụng hợp chất mangan đioxit.
O2 (oxi )

Oxy là một chất khí không màu, không mùi và không vị là một chất khí thiết yếu cho việc tồn tại của con người. Oxy có nhiều ứng dụng trong ngành sản xuất thép và những quá trình luyện, sản xuất sắt kẽm kim loại khác, trong hóa chất, dược phẩm, chế biến dầu khí, sản xuất thủy tinh và gốm cũng như sản xuất giấy và bột giấy. Nó còn được sử dụng để bảo vệ môi trường tự nhiên thiên nhiên trong những nhà máy sản xuất và cơ sở xử lý nước thải đô thị và công nghiệp. Oxy có nhiều ứng dụng trong chăm sóc sức khỏe, cả trong bệnh viện, trung tâm điều trị ngoại trú và sử dụng tại nhà.
1. Vai trò sinh học của oxi
Oxi có một ý nghãi rất là to lớn về mặt sinh học. Nếu không còn oxi thì những động vật máu nóng sẽ chết sau vài phút. Những động vật máu lạnh kém nhạy hơn về mặt đó, nhưng không thể sống thiếu oxi được. Khi hô hấp, động vật hấp thụ khí oxy và thải khí cacbonic, còn cây xanh ban ngày hấp thụ khí carbonic và thải khí oxi và ban đêm lại hấp thụ oxi và thải khí cacbonic. Chỉ một số trong những sinh vật bậc thấp gọi là sinh vật yếm khí như men, một số trong những vi khuẩn... hoàn toàn có thể tồn tại không cần oxi. Động vật sống ở mặt đất lấy oxi từ không khí nhờ phổi, hai lá phổi của người dân có một mặt phẳng tiếp xúc với không khí khoảng chừng 400m2 và mặt phẳng đó luôn luôn đổi mới. Động vật ở dưới mước hấp thụ khí oxi đã tan trong nước nhờ những khí quản hoặc nhờ trực tiếp những màng tế bào, in như ở động vật bậc thấp.
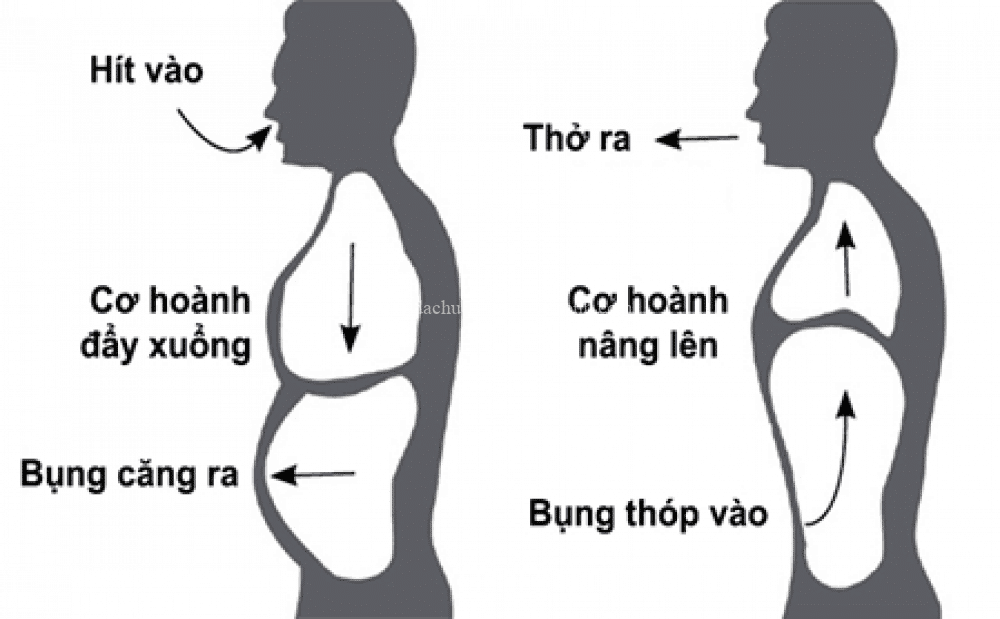
Nếu không còn oxi thì những động vật máu nóng sẽ chết sau vài phút. Những động vật máu lạnh kém nhạy hơn về mặt đó, nhưng không thể sống thiếu oxi được.
Khi không khí tiếp xúc với máu ở phổi, oxi kết phù phù hợp với hemoglobin trong hồng cầu tạo nên oxihemoglobin là hợp chất kém bền dễ phân hủy. Trong quá trình vận chuyển của máu ở trong động vật, hợp chất đó chui qua mạch mao quản của những đơn vị trong khung hình. Ở đó áp suất riêng của oxi rất thấp vì có nhu yếu liên tục về oxi. Trong điều kiện đó, oxihemoglobin phân hủy thành hemoglobin và oxi, rồi oxi qua thành mao quản khuếch tán vào những mô tế bào. Trong những mô, oxi tham gia vào những quá trình oxi hóa chậm những chất dinh dưỡng đã được chuyển đến tế bào và sinh ra năng lượng thiết yếu cho việc sống. Mỗi giờ một người lớn thở vào khoảng chừng 0,5m3 không khí, khung hình giữ lại 1/3 lượng oxi có trong không khí. Như vậy thực tế từng người một ngày đêm cần khoảng chừng 0,5m3 oxi và thải ra khoảng chừng 0,4m3 khí cacbonic.
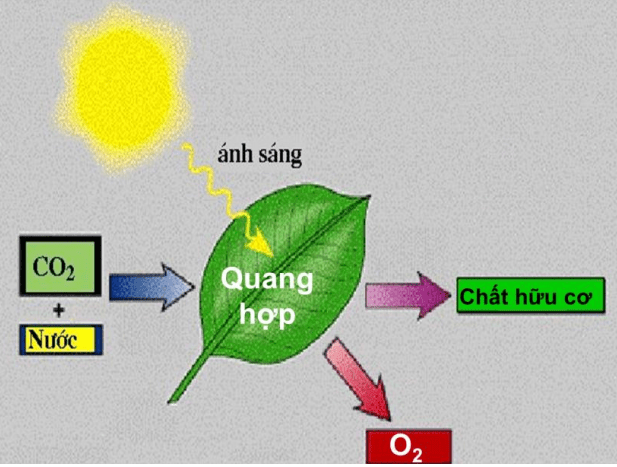
Qúa trình quang hợp của thực vật
2. Ứng dụng của oxy

Ứng dụng của oxi
a. Trong công nghiệp luyện kimOxy được sử dụng với khí nhiên liệu trong hàn khí, cắt khí, quấn khăn oxy, làm sạch ngọn lửa, làm cứng ngọn lửa và làm thắng ngọn lửa.
Trong quá trình cắt khí oxy phải có rất chất lượng để đảm bảo tốc độ cắt cao và đường cắt sạch.
Phần lớn oxy được sử dụng cho ngành công nghiệp thép. Sản xuất thép tân tiến đa phần nhờ vào việc sử dụng oxy để làm giàu không khí và tăng nhiệt độ đốt cháy trong lò cao và lò nung hở cũng như thay thế than cốc bằng những vật liệu dễ cháy khác. Trong quá trình luyện thép, hàm lượng cacbon tạp chất kết phù phù hợp với oxy để tạo thành oxit cacbon và chúng thoát ra ở dạng khí. Oxy được đưa vào bể thép thông qua một cây thương đặc biệt. Oxy cũng khá được sử dụng để tạo ra những sắt kẽm kim loại khác ví dụ như đồng, chì, kẽm.

Phần lớn oxy được sử dụng cho ngành công nghiệp thép. Sản xuất thép tân tiến đa phần nhờ vào việc sử dụng oxy để làm giàu không khí và tăng nhiệt độ đốt cháy trong lò cao và lò nung hở cũng như thay thế than cốc bằng những vật liệu dễ cháy khác.
Việc làm giàu oxy của không khí đốt, hoặc phun oxy qua ống dẫn được sử dụng ngày càng nhiều trong những lò nung nhỏ, lò nung lộ thiên, lò luyện thủy tinh và bông khoáng, lò nung vôi và xi măng, để nâng cao hiệu suất và giảm nhu yếu năng lượng. Thời gian nấu chảy và tiêu thụ năng lượng cũng hoàn toàn có thể được giảm sút bằng phương pháp đốt oxy - dầu hoặc oxy - khí đặc biệt trong những lò luyện thép điện và lò luyện nhôm cảm ứng. Hiệu suất nhiệt cao đạt được nhờ những đầu đốt "oxy - nhiên liệu", trộn nhiên liệu và oxy ở đầu đầu đốt. Kết quả là sự việc cháy xảy ra nhanh ở khoảng chừng 2800oC.
b. Trong hóa chất, dược phẩm và dầu mỏOxy được sử dụng làm nguyên vật liệu trong nhiều quá trình oxy hóa, gồm có sản xuất ethylene oxide, propylene oxide, khí tổng hợp bằng phương pháp sử dụng quá trình oxy hóa một phần nhiều loại hydrocarbon, ethylene dichoride, hydrogen peroxide, acid nitric, vinyl clorua và axit phthalic.
Một lượng rất lớn oxy được sử dụng trong quá trình khí hóa than - để tạo ra khí tổng hợp hoàn toàn có thể được sử dụng làm nguyên vật liệu hóa học hoặc tiền chất cho những loại nhiên liệu dễ vận chuyển và dễ sử dụng hơn.
Trong những nhà máy sản xuất lọc dầu, oxy được sử dụng để làm giàu không khí cấp cho những máy tái sinh cracking xúc tác, làm tăng hiệu suất của những tổ máy. Nó được sử dụng trong những đơn vị thu hồi lưu huỳnh để đạt được nhưng quyền lợi tương tự. Oxy cũng khá được sử dụng để tái tạo chất xúc tác.
Oxy được sử dụng để đốt cháy và tiêu hủy hoàn toàn hơn những vật liệu độc hại và chất thải trong lò đốt.
c. Trong công nghiệp thủy tinh và gốm sứViệc quy đổi khối mạng lưới hệ thống đốt cháy từ nhiên liệu không khí sang nhiên liệu oxy (và xây dựng những lò và bể chứa mới xung quanh công nghệ tiên tiến này) giúp trấn áp tốt hơn những kiểu gia nhiệt, hiệu suất lò cao hơn (Tiêu thụ nhiên liệu thấp hơn) và giảm phát thải hạt và NOx.
d. Sử dụng sản xuất bột giấy và giấyOxy ngày càng quan trọng như một hóa chất tẩy trắng. Trong sản xuất bột giấy tẩy trắng rất chất lượng, lignin trong bột giấy phải được vô hiệu trong quá trình tẩy trắng. Clo đã được sử dụng cho mục tiêu này nhưng những quy trình mới sử dụng oxy làm giảm ô nhiễm nước. Oxy và xút ăn da hoàn toàn có thể thay thế hypochlorite và chlorine dioxide trong quá trình tẩy trắng, dẫn đến ngân sách thấp hơn.
Trong nhà máy sản xuất sản xuất bột giấy hóa học, oxy được tương hỗ update vào không khí đốt làm tăng năng suất sản xuất của lò hơi thu hồi sôđa và lò nung vôi. Việc sử dụng oxy trong quá trình oxy hóa rượu đen làm giảm việc thải những chất ô nhiễm lưu huỳnh vào khí quyển.
e. Sử dụng chăm sóc sức khỏeTrong y học, oxy được sử dụng trong quá trình phẫu thuật, điều trị chăm sóc đặc biệt, liệu pháp hít thở, vv Phải duy trì những tiêu chuẩn cao về độ tinh khiết và xử lý.
Oxy thường được đáp ứng cho những bệnh viện thông qua phân phối chất lỏng số lượng lớn, sau đó được phân phối đến những điểm sử dụng. Nó tương hỗ những vấn đề về hô hấp, cứu sống và tăng sự thoải mái cho bệnh nhân.
Các thiết bị tách khí không khiến lạnh di động nhỏ đang được sử dụng rộng rãi trong việc chăm sóc mái ấm gia đình. Các đơn vị quy mô to hơn cũng sử dụng công nghệ tiên tiến tách khí không đông lạnh, đang được sử dụng trong những bệnh viện nhỏ và / hoặc vùng sâu vùng xa, nơi nhu yếu đủ cao để khiến việc phân phối xi lanh trở thành vấn đề phục vụ hầu cần nhưng việc phân phối chất lỏng không còn sẵn hoặc rất tốn kém. Các đơn vị này thường tạo ra ôxy tinh khiết từ 90 đến 93%, đủ cho hầu hết những mục tiêu sử dụng trong y tế.

Máy tạo oxy dành riêng cho những người dân bệnh
f. Trong môi trường tự nhiên thiên nhiênTrong xử lý sinh học nước thải, việc sử dụng oxy thay vì không khí được cho phép tăng hiệu suất trong những nhà máy sản xuất xử lý hiện có. Tiêm oxy vào cống rãnh làm giảm sự hình thành hydrogen sulfide, dẫn đến giảm ăn mòn và mùi hôi.
Ozone được sử dụng để xử lý nước uống, đặc biệt khi những chất thay thế, ví dụ như clo, là không mong ước.
g. Các ứng dụng khác đối với oxy:Oxy có nhiều hiệu suất cao trong thiết bị thở, ví dụ như những thiết bị thở khép kín cho việc làm dưới nước và nhà máy sản xuất lọc dầu và nhà máy sản xuất hóa chất.
Nuôi trồng thủy sản, nuôi cá trong ao, sử dụng nước có ôxy để đảm bảo luôn có đủ ôxy và được cho phép nhiều cá được nuôi hoặc nuôi trong một kích thước ao hoặc bể nhất định.
Oxy lỏng được sử dụng trong tên lửa nhiên liệu lỏng làm chất oxy hóa cho những nhiên liệu như hydro và metan lỏng.
Lưu ý
Nếu khung hình hít phải 100% oxy hoàn toàn có thể gây buồn nôn, chóng mặt, kích thích phổi, phù phổi, viêm phổi và hoàn toàn có thể gây chết người. Oxy lỏng thì gây tê cóng mắt và da.
K2MnO4 (kali manganat )
.png)
Kali manganate (VII) được sử dụng rộng rãi như một tác nhân oxy hóa và như một chất khử trùng trong một loạt những ứng dụng, và như một thuốc thử phân tích.
Page 2Nếu chưa thấy hết, hãy kéo sang phải để thấy hết phương trình ==>
Hãy kéo xuống dưới để xem điều kiện phản ứng
và Download Đề Cương Luyện Thi Miễn Phí
Xin hãy kéo xuống dưới để xem và thực hành những thắc mắc trắc nghiệm liên quan
☟☟☟
Phương Trình Hoá Học Lớp 9 Phương Trình Hoá Học Lớp 11 Phản ứng oxi-hoá khử Phản ứng nhiệt phân
nhiệt phân KNO3.
Hiện tượng nhận ra 2KNO3 => 2KNO2 + O2
Xuất hiện chất rắn white color Kali nitrit (KNO2) và khí Oxi (O2) làm sủi bọt khí.
tin tức thêm
Muối kali nitrat bị phân huỷ ở nhiệt độ cao tạo thành muối kali nitrit và giải phóng khí oxi, vì vậy nó có tính chất oxi hoá mạnh.
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ KNO3 (kali nitrat; diêm tiêu) ra KNO2 (kali nitrit)
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ KNO3 (kali nitrat; diêm tiêu) ra O2 (oxi)

Muối kali nitrat dùng để: Chế tạo thuốc nổ đen với công thức: 75% KNO3, 10% S và 15% C. Khi nổ, nó tạo ra muối kali sunfua, khí nitơ và khí CO2: 2KNO3 + S + 3C →to K2S + 3CO2 + N2. Làm phân bón, đáp ứng nguyên tố kali và nitơ cho cây trồng. Bảo quản thực phẩm trong công nghiệp. Điều chế oxi với lượng nhỏ trong phòng thí nghiệm bằng phản ứng nhiệt phân. Điều chế HNO3 khi tác dụng với axit khó bay hơi: H2SO4 + 2KNO3 → K2SO4 + 2HNO3. Phụ gia thực phẩm (E252). Kem đánh răng trị ê buốt.
KNO2 (kali nitrit )

Kali nitrit (cần phân biệt với kali nitrat) là một hợp chất vô cơ với công thức hóa học KNO2. Nó là một muối ion tạo thành từ những ion kali K+ và ion nitrit NO2−, tạo thành một tinh thể white color hoặc hơi vàng, có tính hút ẩm và hòa tan trong nước. Nó là một chất oxy hóa mạnh và hoàn toàn có thể đẩy nhanh quá trình đốt những vật liệu khác. Giống như những muối nitrit khác ví như natri nitrit, kali nitrit là chất độc nếu nuốt phải, và xét nghiệm đã cho tất cả chúng ta biết nó hoàn toàn có thể gây đột biến hoặc gây quái thai. Găng tay và kính bảo vệ an toàn và đáng tin cậy thường được sử dụng khi xử lý kali nitrit.
O2 (oxi )

Oxy là một chất khí không màu, không mùi và không vị là một chất khí thiết yếu cho việc tồn tại của con người. Oxy có nhiều ứng dụng trong ngành sản xuất thép và những quá trình luyện, sản xuất sắt kẽm kim loại khác, trong hóa chất, dược phẩm, chế biến dầu khí, sản xuất thủy tinh và gốm cũng như sản xuất giấy và bột giấy. Nó còn được sử dụng để bảo vệ môi trường tự nhiên thiên nhiên trong những nhà máy sản xuất và cơ sở xử lý nước thải đô thị và công nghiệp. Oxy có nhiều ứng dụng trong chăm sóc sức khỏe, cả trong bệnh viện, trung tâm điều trị ngoại trú và sử dụng tại nhà.
1. Vai trò sinh học của oxi
Oxi có một ý nghãi rất là to lớn về mặt sinh học. Nếu không còn oxi thì những động vật máu nóng sẽ chết sau vài phút. Những động vật máu lạnh kém nhạy hơn về mặt đó, nhưng không thể sống thiếu oxi được. Khi hô hấp, động vật hấp thụ khí oxy và thải khí cacbonic, còn cây xanh ban ngày hấp thụ khí carbonic và thải khí oxi và ban đêm lại hấp thụ oxi và thải khí cacbonic. Chỉ một số trong những sinh vật bậc thấp gọi là sinh vật yếm khí như men, một số trong những vi khuẩn... hoàn toàn có thể tồn tại không cần oxi. Động vật sống ở mặt đất lấy oxi từ không khí nhờ phổi, hai lá phổi của người dân có một mặt phẳng tiếp xúc với không khí khoảng chừng 400m2 và mặt phẳng đó luôn luôn đổi mới. Động vật ở dưới mước hấp thụ khí oxi đã tan trong nước nhờ những khí quản hoặc nhờ trực tiếp những màng tế bào, in như ở động vật bậc thấp.
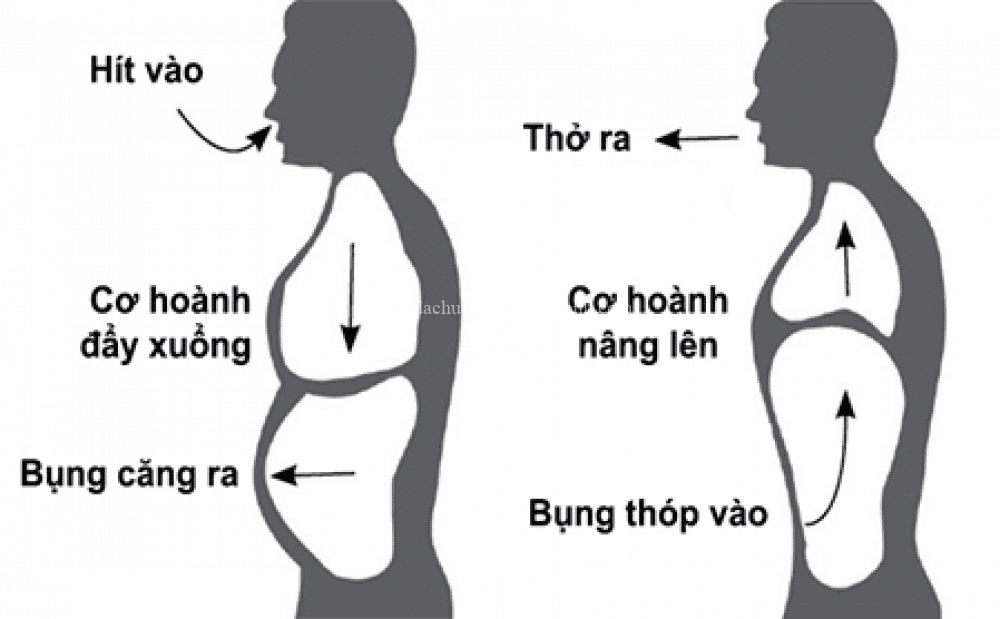
Nếu không còn oxi thì những động vật máu nóng sẽ chết sau vài phút. Những động vật máu lạnh kém nhạy hơn về mặt đó, nhưng không thể sống thiếu oxi được.
Khi không khí tiếp xúc với máu ở phổi, oxi kết phù phù hợp với hemoglobin trong hồng cầu tạo nên oxihemoglobin là hợp chất kém bền dễ phân hủy. Trong quá trình vận chuyển của máu ở trong động vật, hợp chất đó chui qua mạch mao quản của những đơn vị trong khung hình. Ở đó áp suất riêng của oxi rất thấp vì có nhu yếu liên tục về oxi. Trong điều kiện đó, oxihemoglobin phân hủy thành hemoglobin và oxi, rồi oxi qua thành mao quản khuếch tán vào những mô tế bào. Trong những mô, oxi tham gia vào những quá trình oxi hóa chậm những chất dinh dưỡng đã được chuyển đến tế bào và sinh ra năng lượng thiết yếu cho việc sống. Mỗi giờ một người lớn thở vào khoảng chừng 0,5m3 không khí, khung hình giữ lại 1/3 lượng oxi có trong không khí. Như vậy thực tế từng người một ngày đêm cần khoảng chừng 0,5m3 oxi và thải ra khoảng chừng 0,4m3 khí cacbonic.
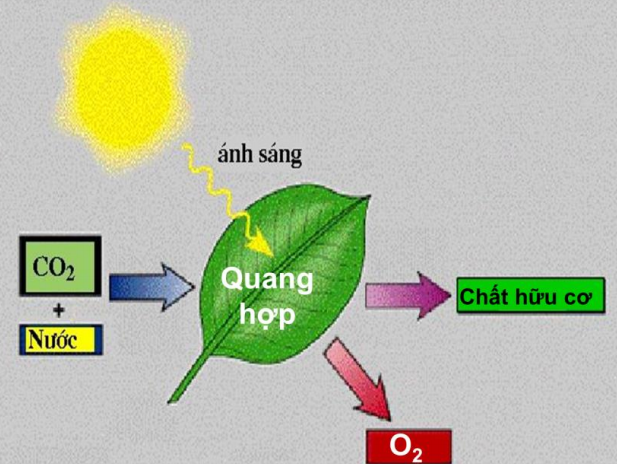
Qúa trình quang hợp của thực vật
2. Ứng dụng của oxy

Ứng dụng của oxi
a. Trong công nghiệp luyện kimOxy được sử dụng với khí nhiên liệu trong hàn khí, cắt khí, quấn khăn oxy, làm sạch ngọn lửa, làm cứng ngọn lửa và làm thắng ngọn lửa.
Trong quá trình cắt khí oxy phải có rất chất lượng để đảm bảo tốc độ cắt cao và đường cắt sạch.
Phần lớn oxy được sử dụng cho ngành công nghiệp thép. Sản xuất thép tân tiến đa phần nhờ vào việc sử dụng oxy để làm giàu không khí và tăng nhiệt độ đốt cháy trong lò cao và lò nung hở cũng như thay thế than cốc bằng những vật liệu dễ cháy khác. Trong quá trình luyện thép, hàm lượng cacbon tạp chất kết phù phù hợp với oxy để tạo thành oxit cacbon và chúng thoát ra ở dạng khí. Oxy được đưa vào bể thép thông qua một cây thương đặc biệt. Oxy cũng khá được sử dụng để tạo ra những sắt kẽm kim loại khác ví dụ như đồng, chì, kẽm.

Phần lớn oxy được sử dụng cho ngành công nghiệp thép. Sản xuất thép tân tiến đa phần nhờ vào việc sử dụng oxy để làm giàu không khí và tăng nhiệt độ đốt cháy trong lò cao và lò nung hở cũng như thay thế than cốc bằng những vật liệu dễ cháy khác.
Việc làm giàu oxy của không khí đốt, hoặc phun oxy qua ống dẫn được sử dụng ngày càng nhiều trong những lò nung nhỏ, lò nung lộ thiên, lò luyện thủy tinh và bông khoáng, lò nung vôi và xi măng, để nâng cao hiệu suất và giảm nhu yếu năng lượng. Thời gian nấu chảy và tiêu thụ năng lượng cũng hoàn toàn có thể được giảm sút bằng phương pháp đốt oxy - dầu hoặc oxy - khí đặc biệt trong những lò luyện thép điện và lò luyện nhôm cảm ứng. Hiệu suất nhiệt cao đạt được nhờ những đầu đốt "oxy - nhiên liệu", trộn nhiên liệu và oxy ở đầu đầu đốt. Kết quả là sự việc cháy xảy ra nhanh ở khoảng chừng 2800oC.
b. Trong hóa chất, dược phẩm và dầu mỏOxy được sử dụng làm nguyên vật liệu trong nhiều quá trình oxy hóa, gồm có sản xuất ethylene oxide, propylene oxide, khí tổng hợp bằng phương pháp sử dụng quá trình oxy hóa một phần nhiều loại hydrocarbon, ethylene dichoride, hydrogen peroxide, acid nitric, vinyl clorua và axit phthalic.
Một lượng rất lớn oxy được sử dụng trong quá trình khí hóa than - để tạo ra khí tổng hợp hoàn toàn có thể được sử dụng làm nguyên vật liệu hóa học hoặc tiền chất cho những loại nhiên liệu dễ vận chuyển và dễ sử dụng hơn.
Trong những nhà máy sản xuất lọc dầu, oxy được sử dụng để làm giàu không khí cấp cho những máy tái sinh cracking xúc tác, làm tăng hiệu suất của những tổ máy. Nó được sử dụng trong những đơn vị thu hồi lưu huỳnh để đạt được nhưng quyền lợi tương tự. Oxy cũng khá được sử dụng để tái tạo chất xúc tác.
Oxy được sử dụng để đốt cháy và tiêu hủy hoàn toàn hơn những vật liệu độc hại và chất thải trong lò đốt.
c. Trong công nghiệp thủy tinh và gốm sứViệc quy đổi khối mạng lưới hệ thống đốt cháy từ nhiên liệu không khí sang nhiên liệu oxy (và xây dựng những lò và bể chứa mới xung quanh công nghệ tiên tiến này) giúp trấn áp tốt hơn những kiểu gia nhiệt, hiệu suất lò cao hơn (Tiêu thụ nhiên liệu thấp hơn) và giảm phát thải hạt và NOx.
d. Sử dụng sản xuất bột giấy và giấyOxy ngày càng quan trọng như một hóa chất tẩy trắng. Trong sản xuất bột giấy tẩy trắng rất chất lượng, lignin trong bột giấy phải được vô hiệu trong quá trình tẩy trắng. Clo đã được sử dụng cho mục tiêu này nhưng những quy trình mới sử dụng oxy làm giảm ô nhiễm nước. Oxy và xút ăn da hoàn toàn có thể thay thế hypochlorite và chlorine dioxide trong quá trình tẩy trắng, dẫn đến ngân sách thấp hơn.
Trong nhà máy sản xuất sản xuất bột giấy hóa học, oxy được tương hỗ update vào không khí đốt làm tăng năng suất sản xuất của lò hơi thu hồi sôđa và lò nung vôi. Việc sử dụng oxy trong quá trình oxy hóa rượu đen làm giảm việc thải những chất ô nhiễm lưu huỳnh vào khí quyển.
e. Sử dụng chăm sóc sức khỏeTrong y học, oxy được sử dụng trong quá trình phẫu thuật, điều trị chăm sóc đặc biệt, liệu pháp hít thở, vv Phải duy trì những tiêu chuẩn cao về độ tinh khiết và xử lý.
Oxy thường được đáp ứng cho những bệnh viện thông qua phân phối chất lỏng số lượng lớn, sau đó được phân phối đến những điểm sử dụng. Nó tương hỗ những vấn đề về hô hấp, cứu sống và tăng sự thoải mái cho bệnh nhân.
Các thiết bị tách khí không khiến lạnh di động nhỏ đang được sử dụng rộng rãi trong việc chăm sóc mái ấm gia đình. Các đơn vị quy mô to hơn cũng sử dụng công nghệ tiên tiến tách khí không đông lạnh, đang được sử dụng trong những bệnh viện nhỏ và / hoặc vùng sâu vùng xa, nơi nhu yếu đủ cao để khiến việc phân phối xi lanh trở thành vấn đề phục vụ hầu cần nhưng việc phân phối chất lỏng không còn sẵn hoặc rất tốn kém. Các đơn vị này thường tạo ra ôxy tinh khiết từ 90 đến 93%, đủ cho hầu hết những mục tiêu sử dụng trong y tế.

Máy tạo oxy dành riêng cho những người dân bệnh
f. Trong môi trường tự nhiên thiên nhiênTrong xử lý sinh học nước thải, việc sử dụng oxy thay vì không khí được cho phép tăng hiệu suất trong những nhà máy sản xuất xử lý hiện có. Tiêm oxy vào cống rãnh làm giảm sự hình thành hydrogen sulfide, dẫn đến giảm ăn mòn và mùi hôi.
Ozone được sử dụng để xử lý nước uống, đặc biệt khi những chất thay thế, ví dụ như clo, là không mong ước.
g. Các ứng dụng khác đối với oxy:Oxy có nhiều hiệu suất cao trong thiết bị thở, ví dụ như những thiết bị thở khép kín cho việc làm dưới nước và nhà máy sản xuất lọc dầu và nhà máy sản xuất hóa chất.
Nuôi trồng thủy sản, nuôi cá trong ao, sử dụng nước có ôxy để đảm bảo luôn có đủ ôxy và được cho phép nhiều cá được nuôi hoặc nuôi trong một kích thước ao hoặc bể nhất định.
Oxy lỏng được sử dụng trong tên lửa nhiên liệu lỏng làm chất oxy hóa cho những nhiên liệu như hydro và metan lỏng.
Lưu ý
Nếu khung hình hít phải 100% oxy hoàn toàn có thể gây buồn nôn, chóng mặt, kích thích phổi, phù phổi, viêm phổi và hoàn toàn có thể gây chết người. Oxy lỏng thì gây tê cóng mắt và da.
Page 3Nếu chưa thấy hết, hãy kéo sang phải để thấy hết phương trình ==>
Hãy kéo xuống dưới để xem điều kiện phản ứng
và Download Đề Cương Luyện Thi Miễn Phí
Xin hãy kéo xuống dưới để xem và thực hành những thắc mắc trắc nghiệm liên quan
☟☟☟
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ H2O (nước) ra H2 (hidro)
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ H2O (nước) ra KOH (kali hidroxit)
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ K (kali) ra H2 (hidro)
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ K (kali) ra KOH (kali hidroxit)

Nước là một hợp chất liên quan trực tiếp và rộng rãi đến sự sống trên Trái Đất, là cơ sở của sự việc sống đối với mọi sinh vật. Đối với thế giới vô sinh, nước là một thành phần tham gia rộng rãi vào những phản ứng hóa học, nước là dung môi và là môi trường tự nhiên thiên nhiên tàng trữ những điều kiện để thúc đẩy hay ngưng trệ những quá trình hóa học. Đối với con người nước là thành phần chiếm tỷ trọng lớn số 1.

Nước là một hợp chất liên quan trực tiếp và rộng rãi đến sự sống trên Trái Đất, là cơ sở của sự việc sống đối với mọi sinh vật
1. Tài nguyên nước và quy trình nước toàn cầu
Trái Đất có tầm khoảng chừng 361 triệu km2 diện tích s quy hoạnh những đại dương (71% diện tích s quy hoạnh mặt phẳng Trái Đất). Trữ lượng tài nguyên nước có tầm khoảng chừng 1,5 tỉ km3, trong đó nước nội địa chỉ chiếm khoảng chừng 91 triệu km3 (6,1%), còn 93,9% nước biển và đại dương. Tài nguyên nước ngọt chiếm 28,25 triệu km3 (1,88 % thủy quyển), nhưng phần lớn lại ở dạng đóng băng ở hai cực Trái Đất. Lượng nước thực tế con người hoàn toàn có thể sử dụng được 4,2 triệu km3 (0,28%) thủy quyển.
Các nguồn nước trong tự nhiên không ngừng nghỉ vận động và chuyển trạng thái (lỏng, khí, rắn) tạo nên vòng tuần hoàn nước trong sinh quyển: Nước bốc hơi, ngưng tụ và mưa. Nước vận chuyển trong những quyển, hòa tan và mang theo nhiều chất dinh dưỡng, chất khoáng và một số trong những chất thiết yếu cho đời sống của động và thực vật.

Chu trình tuần hoàn của nước
Nước ao, hồ, sông và đại dương... nhờ năng lượng Mặt Trời bốc hơi vào khí quyển, hơi nước ngưng tụ lại rồi mưa rơi xuống mặt phẳng Trái Đất. Nước chu chuyển trong phạm vi toàn cầu, tạo nên những cân đối nước và tham gia vào quá trình điều trung khí hậu Trái Đất. Hơi nước thoát từ những loài thực vật làm tăng độ ẩm của không khí. Một phần nước mưa thấm qua đất thành nước ngầm, nước ngầm và nước mặt phẳng đều hướng ra phía biển để tuần hoàn trở lại, đó là quy trình nước. Tuy nhiên, lượng nước ngọt và nước mưa trên hành tinh phân bố không đều. Hiện nay, hàng trăm trên toàn thế giới mới sử dụng khoảng chừng 4.000 km3 nước ngọt, chiếm khoảng chừng 40% lượng nước ngọt hoàn toàn có thể khai thác được.
2. Vai trò của nước
Nước ngọt là tài nguyên hoàn toàn có thể tái tạo được, nhưng sử dụng phải cân đối giữa nguồn nước dự trữ và tái tạo. Sử dụng nên phải hợp lý nếu muốn cho việc sống tiếp diễn lâu dài, vì hết nước thì môi trường tự nhiên thiên nhiên sống đời thường của động - thực vật sẽ không tồn tại.
Trong Vũ trụ bát ngát chỉ có Trái Đất là có nước ở dạng lỏng, vì vậy giá trị của nước sau nhiều thập kỷ xem xét đã được đánh giá "Như dòng máu nuôi khung hình con người dưới một danh từ là máu sinh học của Trái Đất, do vậy nước quý hơn vàng"
Điều kiện hình thành đời sống thực vật phải có nước, nước đó đó là biểu lộ nơi muôn loài hoàn toàn có thể sống được, đó là giá trị đích thực của nước.
Môi trường nước không tồn tại cô lập với những môi trường tự nhiên thiên nhiên khác, nó luôn tiếp xúc trực tiếp với không khí, đất và sinh quyển. Phản ứng hóa học trong môi trường tự nhiên thiên nhiên nước có rất nhiều nét đặc thù khi so sánh với cùng phản ứng đó trong phòng thí nghiệm hay trong sản xuất công nghiệp. Nguyên nhân của sự việc khác lạ đó là tính không cân đối nhiệt động của hệ do tính "mở" tiếp xúc trực tiếp với khí quyển, thạch quyển, sinh quyển và số tạp chất trong nước cực kỳ đa dạng. giữa chúng luôn có quá trình trao đổi chất, năng lượng (nhiệt, quang, cơ năng), xảy ra sôi động giữa mặt phẳng phân cách pha. Ngay trong lòng nước cũng xảy ra những quá trình xa lạ với quy luật cân đối hóa học - quá trình giảm entropi, sự hình thành và phát triển của những vi sinh vật.
a. Đời sống con ngườiNước rất thiết yếu cho hoạt động và sinh hoạt giải trí sống của con người cũng như những sinh vật. Con người hoàn toàn có thể không ăn trong nhiều ngày mà vẫn sống, nhưng sẽ bị chết chỉ với sau ít ngày (khoảng chừng 3 ngày) nhịn khát, vì khung hình người dân có tầm khoảng chừng 65 - 86% nước, nếu mất 12% nước khung hình sẽ bị hôn mê và hoàn toàn có thể chết.
Để hoạt động và sinh hoạt giải trí thông thường, khung hình cần từ một đến bảy lít nước mỗi ngày để tránh mất nước; số lượng đúng chuẩn phụ thuộc vào mức độ hoạt động và sinh hoạt giải trí, nhiệt độ, độ ẩm và những yếu tố khác. Hầu hết lượng này được tiêu hóa qua nhiều chủng loại thực phẩm hoặc đồ uống khác ngoài việc uống nước lọc. Theo Thương Hội Dinh dưỡng Anh khuyên rằng, đối với một người khỏe mạnh thì cần khoảng chừng 2,5 lít tổng lượng nước mỗi ngày là mức tối thiểu để duy trì lượng nước thích hợp.

Mỗi ngày trung bình từng người cần khoảng chừng 2,5 đến 4 lít nước để đáp ứng cho khung hình. Khi khung hình mất từ 10 đến 20 % lượng nước hoàn toàn có thể trong khung hình, động vật hoàn toàn có thể chết.
Thận khỏe mạnh hoàn toàn có thể bài tiết từ 0,8 lít đến 1 lít nước mỗi giờ, nhưng căng thẳng mệt mỏi như tập thể dục hoàn toàn có thể làm giảm lượng nước này. Mọi người hoàn toàn có thể uống nhiều nước hơn mức thiết yếu trong khi tập thể dục, khiến họ có rủi ro tiềm ẩn tiềm ẩn bị nhiễm độcnước hoàn toàn có thể gây tử vong.
Cụ thể, lượng nước thiết yếu dành riêng cho từng loại đối tượng như sau:
- Đàn ông tiêu thụ khoảng chừng 3 lít, phụ nữ là 2,2 lít
- Phụ nữ mang thai cần 2,4 lít và phụ nữ đang cho con bú cần uống khoảng chừng 3 lít chính bới một lượng lớn chất lỏng bị mất trong quá trình cho con bú.
Khoảng 20 % lượng nước nạp vào là từ thức ăn, trong khi phần còn sót lại đến hơi thở. Khi gắng sức và tiếp xúc với nhiệt, lượng nước mất đi sẽ tăng lên và nhu yếu chất lỏng hằng ngày cũng hoàn toàn có thể tăng lên.
b. Công nghiệp và nông nghiệpNhu cầu nước cho sản xuất công nghiệp và nhất là nông nghiệp rất lớn. Để khai thác một tấn dầu mỏ nên phải có 10m3 nước, muốn sản xuất một tấn sợi tổng hợp nên phải có 5600 m3 nước, một trung tâm nhiệt điện tân tiến với hiệu suất 1 triệu kW cần đến 1,2 - 1,6 tỉ m3 nước trong một năm.
Tóm lại, nước có một vai trò quan trọng không thể thiếu được cho việc sống tồn tại trên Trái Đất, là máu sinh học của Trái Đất nhưng nước cũng là nguồn gây tử vong cho một người, cho nhiều người và cả một hiệp hội rộng lớn. Vì vậy, nói đến nước là nói tới việc bảo vệ rừng, trồng rừng, phát triển rừng để tái tạo lại nguồn nước, hạn chế cường độ dòng lũ lụt, để sử dụng nguồn nước làm thủy điện, để đáp ứng nước sạch. Phải sử dụng hợp lý nước sinh hoạt và sản xuất đi đôi với việc chống ô nhiễm nguồn nước đã khai thác sử dụng, phải xử lý nước thải sản xuất và sinh hoạt.
3. Sự thật thú vị
- Khoảng 97% nước của Trái Đất là nước mặn (biển, đại dương), có hàm lượng muối cao, không thích hợp cho nhu yếu sinh hoạt của con người. Khoảng 2% nước thuộc dạng băng đá nằm ở hai cực Trái Đất. Chỉ có một% nước của Trái Đất kể trên được con người tiêu dùng, trong đó: khoảng chừng 30% dùng cho mục tiêu tưới tiêu, 50% dùng cho những nhà máy sản xuất sản xuất năng lượng, 7% dùng cho sinh hoạt và 12% dùng cho sản xuất công nghiệp.

Khoảng 97% nước của Trái Đất là nước mặn (biển, đại dương), có hàm lượng muối cao, không thích hợp cho nhu yếu sinh hoạt của con người.
- Nước mặt phẳng dễ bị ô nhiễm bởi hóa chất bảo vệ thực vật, phân bón, chất thải của con người và động vật có trong nước thải sinh hoạt và nước thải công nghiệp.
- Bên cạnh đó, nước còn là một một trong những chỉ tiêu xác định mức độ phát triển của nền kinh tế tài chính xã hội. Thí dụ, để đã có được 1 tấn sản phẩm thì lượng nước cần tiêu thụ như sau: than thì cần từ 3 đến 5 tấn nước; dầu mỏ từ 30 đến 50 tấn nước; giấy từ 200 - 300 tấn nước; gạo từ 5000 - 10000 tấn nước; thịt từ 20000 - 30000 tấn nước.
- Bạn có biết nước tinh khiết nhất ở trong thiên nhiên là nước mưa và tuyết không? Nhưng chúng cũng chứa một số trong những khí tan được và những chất khác có ở trong khí quyển như O2, N2, CO2, những muối amoni nitrat, nitrit và cacbonat, những dấu vết của những chất hữu cơ, bụi.
- Nước ngầm là nước mưa rơi xuống mặt đất, thấm qua những lớp thấm nước như đất, cát đi đến lớp không thấm nước như đất sét sẽ tạo nên hồ nước ngầm. Thành phần của nước ngầm phụ thuộc vào những lớp đất mà nó đi qua và vào thời gian nó tiếp xúc với những lớp đó.
- Nước sông chứa nhiều tạp chất và với lượng nhiều hơn nữa so với nước ngầm. Ngoài những khí tan được của khí quyển như O2, N2, CO2 trong nước sông còn tồn tại những muối carbonat, sulfat, chloride, của một số trong những sắt kẽm kim loại như calci, magie và natri, những chất hữu cơ, một ít chất vô cơ ở dạng lơ lửng.

1. Phân bón: Các ion kali là thành phần thiết yếu trong dinh dưỡng thực vật và được tìm thấy trong hầu hết nhiều chủng loại đất.[8] Chúng được dùng làm phân bón cho nông nghiệp, trồng trọt và thủy canh ở dạng kali clorua (KCl), kali sulfat (K2SO4), hoăc nitrat (KNO3). Phân bón nông nghiệp tiêu thụ 95% những hóa phẩm của kali trên toàn cầu, và khoảng chừng 90% kali được đáp ứng ở dạng KCl.[8] Thành phần kali trong hầu hết thực vật xấp xỉ từ 0,5% đến 2% khối lượng những vụ mùa, thường ở dạng K2O. Các vụ mùa năng suất cao phụ thuộc vào lượng phân bón để tương hỗ update cho lượng kali mất đi do thực vật hấp thu. Hầu hết phân bón chứa kali clorua, trong khi kali sulfat được dùng cho những vụ mùa nhạy cảm với clorua hoặc vụ mùa cần lượng lưu huỳnh cao hơn. Kali sulfat được tạo ra đa phần bằng sự phân giải những khoáng phức của kainit (MgSO4·KCl·3H2O) và langbeinit (MgSO4·K2SO4). Chỉ có rất ít phân bón chứa kali nitrat. Trong năm 2005, khoảng chừng 93% sản lượng kali trên thế giới đã được tiêu thụ bởi những ngành công nghiệp phân bón 2. Thực phẩm Cation kali là dưỡng chất thiết yếu cho con người và sức khỏe. Kali clorua được dùng thay thế cho muối ăn nhằm mục đích giảm lượng đáp ứng natri để trấn áp bệnh cao huyết áp. USDA liệt kê pa tê cà chua, nước cam, củ cải đường, đậu trắng, cà chua, chuối và nhiều nguồn thức ăn khác đáp ứng kali được xếp theo mức độ giảm dầm hàm lượng kali Kali natri tartrate (KNaC4H4O6, Rochelle salt) là một thành phần chính của bột nở; nó cũng khá được sử dụng trong những gương mạ bạc. Kali bromat (KBrO3) là một chất ôxy hóa mạnh (E924), được dùng để tăng độ dẻo và độ nở cao của bột bánh mì. Kali bisulfit (KHSO3) được dùng làm chất dữ gìn và bảo vệ thực phẩm, như trong rượu vang và bia (nhưng không còn trong thịt). Nó cũng khá được sử dụng để tẩy trong dệt-nhuộm và thuộc da 3. Công nghiệp Kali hydroxit KOH là một ba-zơ mạnh, được dùng ở mức độ công nghiệp để trung hòa những a-xít mạnh và yếu, để khống chế pH và để sản xuất những muối kali. Nó cũng khá được dùng để làm bánh xà phòng từ mỡ và dầu trong công nghiệp tẩy rửa và trong những phản ứng thủy phân như những este.Kali nitrat (KNO3) được lấy từ những nguồn tự nhiên như guano và evaporit hoặc được sản xuất từ công nghệ tiên tiến Haber; nó là một chất ôxy hóa trong thuốc súng (thuốc súng đen) và là một loại phân bón quan trọng. Kali cyanua (KCN) được dùng trong công nghiệp để hòa tan đồng và những sắt kẽm kim loại quý, đặc biệt là bạc và vàng, bằng phương pháp tạo ra ở dạng phức chất. Những ứng dụng của nó gồm khai thác vàng, mạ điện, và đúc điện (electroforming) của những sắt kẽm kim loại này; nó cũng khá được dùng trong tổng hợp hữu cơ để tạo ra nitriles. Kali cacbonat (K2CO3 hay potash) được dùng trong sản xuất thủy tinh, xà phòng, ống phóng màn hình hiển thị màu, đèn huỳnh quan, dệt nhuộm và chất tạo màu Kali permanganat (KMnO4) là một chất ôxi hóa, có tính tẩy mạnh và được sử dụng trong sản xuất saccharin. Kali clorat (KClO3) được cho vào vật liệu nổ. Kali bromua (KBr) đước đây được sử dụng làm thuốc an thần và trong nhiếp ảnh. Kali cromat (K2CrO4) được dùng trong mực,[97] nhuộm, chất tạo màu (màu vàng đỏ sáng); trong chất nổ và pháo hoa; trong thuộc da, trong giấy bẫy ruồi và diêm bảo vệ an toàn và đáng tin cậy, tất cả những ứng dụng trên do tính chất của ion cromat hơn là những ion kali Hợp kim NaK với điểm nóng chảy thấp và sức căng mặt phẳng cao được dùng làm chất làm mát trong một số trong những lò phản ứng hạt nhân nhanh và vệ tinh ra đa RORSAT của Liên Xô.

Một số người coi khí hydro là nhiên liệu sạch của tương lai - được tạo ra từ nước và trở lại nước khi nó bị oxy hóa. Pin nhiên liệu chạy bằng hydro ngày càng được xem là nguồn năng lượng 'không khiến ô nhiễm' và hiện giờ đang được sử dụng trong một số trong những xe buýt và ô tô.
Hydro còn tồn tại nhiều hiệu suất cao khác. Trong công nghiệp hóa chất, nó được sử dụng để sản xuất amoniac cho phân bón nông nghiệp (quy trình Haber) và xyclohexan và metanol, là những chất trung gian trong sản xuất nhựa và dược phẩm. Nó cũng khá được sử dụng để vô hiệu lưu huỳnh khỏi nhiên liệu trong quá trình lọc dầu. Một lượng lớn hydro được sử dụng để hydro hóa dầu để tạo thành chất béo, ví dụ như để sản xuất bơ thực vật.
Trong công nghiệp thủy tinh, hydro được sử dụng làm khí bảo vệ để sản xuất những tấm thủy tinh phẳng. Trong ngành công nghiệp điện tử, nó được sử dụng làm khí xả trong quá trình sản xuất chip silicon.
Mật độ hydro thấp khiến nó trở thành sự lựa chọn tự nhiên cho một trong những ứng dụng thực tế đầu tiên của nó - làm đầy khí cầu và khí cầu. Tuy nhiên, nó phản ứng mạnh mẽ và tự tin với oxy (để tạo thành nước) và tương lai của nó trong việc lấp đầy khí cầu đã kết thúc khi khí cầu Hindenburg bốc cháy.
Vai trò sinh học
Hydro là một nguyên tố thiết yếu cho việc sống. Nó có trong nước và trong hầu hết những phân tử của sinh vật. Tuy nhiên, bản thân hydro không đóng một vai trò đặc biệt tích cực. Nó vẫn link với những nguyên tử carbon và oxy, trong khi hóa học của sự việc sống ra mắt ở những vị trí hoạt động và sinh hoạt giải trí hơn liên quan đến, ví dụ, oxy, nitơ và phốt pho.
Sự phong phú tự nhiên
Hydro thuận tiện và đơn giản là nguyên tố phong phú nhất trong vũ trụ. Nó được tìm thấy trong mặt trời và hầu hết những ngôi sao 5 cánh, và hành tinh sao Mộc có thành phần đa phần là hydro.
Trên Trái đất, hydro được tìm thấy với số lượng lớn số 1 là nước. Nó chỉ tồn tại dưới dạng khí trong khí quyển với một lượng rất nhỏ - dưới 1 phần triệu thể tích. Bất kỳ hydro nào đi vào bầu khí quyển đều nhanh gọn thoát khỏi lực mê hoặc của Trái đất ra ngoài không khí.
Hầu hết hydro được sản xuất bằng phương pháp đốt nóng khí tự nhiên với hơi nước để tạo thành khí tổng hợp (hỗn hợp hydro và carbon monoxide). Khí tổng hợp được tách ra để tạo ra hydro. Hydro cũng hoàn toàn có thể được sản xuất bằng phương pháp điện phân nước.
Trong y học
Hydro có tác dụng hữu ích trong những quy mô động vật bị bệnh về chấn thương do thiếu máu cục bộ tái tưới máu cũng như bệnh viêm và bệnh thần kinh. Ngoài ra, hydro phân tử rất hữu ích cho những ứng dụng y tế và điều trị mới rất khác nhau trong môi trường tự nhiên thiên nhiên lâm sàng. Trong nghiên cứu và phân tích này, nồng độ hydro trong máu và mô của chuột đã được ước tính. Chuột Wistar được cho uống nước siêu giàu hydro (HSRW), tiêm vào màng bụng và tĩnh mạch nước muối siêu giàu hydro (HSRS), và hít khí hydro . Một phương pháp mới để xác định hydronồng độ sau đó được áp dụng bằng phương pháp sử dụng ... sắc ký khí cảm ứng, sau đó mẫu được sẵn sàng sẵn sàng thông qua đồng nhất mô trong những ống kín khí.
Phương pháp này được cho phép xác định nồng độ hydro nhạy và ổn định . Các hydro tập trung đạt đến một đỉnh cao tại 5 phút sau khi uống và màng bụng, so với 1 phút sau khi tiêm tĩnh mạch. Sau khi hít phải khí hydro , nồng độ hydro được tìm thấy đã tăng lên đáng kể ở phút thứ 30 và duy trì mức tương tự sau đó. Những kết quả này chứng tỏ rằng việc xác định đúng chuẩn hydronồng độ trong máu chuột và mô cơ quan rất hữu ích và quan trọng cho việc áp dụng những liệu pháp điều trị và y tế mới rất khác nhau bằng phương pháp sử dụng hydro phân tử. Nước hoặc nước muối siêu giàu hydro .
Khả năng oxy hóa hydro của những mô động vật có vú trong những điều kiện tương tự như điều kiện gặp phải của hỗn hợp thở của thợ lặn sâu có chứa hydro đã được nghiên cứu và phân tích. Thận, gan, lá lách, tim, phổi và cơ tứ đầu đùi đã được lấy ra khỏi chuột lang và chuột cống. Sau khi xay nhỏ hoặc đồng nhất, những mô, cùng với những tế bào bào chế từ tim chuột và tế bào nội mô mao mạch vỏ não của lợn được đặt trong đĩa petri và tiếp xúc với hydro được gắn thẻ triti ở áp suất 1 hoặc 5 megapascal (MPa) trong 1 giờ đặc biệt khối mạng lưới hệ thống phơi phóng được thiết kế. Heli ở áp suất 1 MPa được sử dụng làm chất mang. Đĩa petri chứa đầy nước cất hoặc nước muối dùng để trấn áp âm tính. Sau khi giải nén, mức độ hydro bị oxy hóa bởi những mô và tế bào của động vật có vú được xác định bằng phương pháp đo lượng triti được phối hợp bằng phương pháp đếm chất lỏng. Các mô và tế bào phối hợp tritium chỉ với tốc độ từ 10 đến 50 nanomol trên gam mỗi phút (nmol / g / phút), tốc độ tương tự như tốc độ của những đối chứng âm tính. Các tác giả kết luận rằng những mô của động vật có vú không oxy hóa hydro trong điều kiện khắc nghiệt. Một lượng nhỏ sự phối hợp nhãn triti được quan sát thấy trong những mô hoàn toàn có thể là vì hiện tượng kỳ lạ đồng vị phóng xạ, điều này đặt ra số lượng giới hạn phát hiện để xác định hydro oxy hóa ở 100 nmol / g / phút.
Sản xuất hóa chất
Trong ống thổi oxy-hydro (hàn) và ánh đèn sân khấu; hàn tự động của thép và những sắt kẽm kim loại khác; sản xuất amoniac , metanol tổng hợp, HCl, NH3; hydro hóa dầu, mỡ, naphtalen , phenol ; trong bóng bay và khí cầu; trong luyện kim để khử oxit thành sắt kẽm kim loại; trong lọc dầu; trong phản ứng nhiệt hạch (ion hóa để tạo thành proton, deuteron (D) hoặc triton (T).
Sản xuất amoniac , etanol và anilin ; hydrocracking, hydroforming và hydro hóa dầu mỏ; hydro hóa dầu thực vật; thủy phân than đá; chất khử tổng hợp hữu cơ và quặng sắt kẽm kim loại; khử khí quyển để ngăn ngừa quá trình oxy hóa; như ngọn lửa oxyhdrogen cho nhiệt độ cao; nguyên tử- hàn hydro ; bóng bay mang nhạc cụ; tạo ra hiđro clorua và hiđro bromua ; sản xuất sắt kẽm kim loại có độ tinh khiết cao; nhiên liệu cho động cơ tên lửa hạt nhân để vận chuyển siêu thanh; nhiên liệu tên lửa; nghiên cứu và phân tích đông lạnh.
Năng lượng
Hydro là chất mang năng lượng đa năng hoàn toàn có thể được sử dụng để đáp ứng năng lượng cho hầu hết mọi nhu yếu năng lượng ở đầu cuối. Pin nhiên liệu - một thiết bị quy đổi năng lượng hoàn toàn có thể thu nhận và sử dụng hiệu suất cao năng lượng của hydro - là chìa khóa để biến điều đó thành hiện thực. Pin nhiên liệu tĩnh hoàn toàn có thể được sử dụng để đáp ứng điện dự trữ, cấp điện cho những địa điểm ở xa, phát điện phân tán và đồng phát (trong đó nhiệt lượng dư thừa thải ra trong quá trình phát điện được sử dụng cho những ứng dụng khác). Pin nhiên liệu hoàn toàn có thể đáp ứng năng lượng cho hầu hết mọi ứng dụng di động thường sử dụng pin, từ thiết bị cầm tay đến máy phát điện di động. Pin nhiên liệu cũng hoàn toàn có thể đáp ứng năng lượng cho giao thông vận tải vận tải của tất cả chúng ta, gồm có xe thành viên, xe tải, xe buýt và tàu biển, cũng như đáp ứng năng lượng phụ trợ cho những công nghệ tiên tiến giao thông vận tải truyền thống.
KOH (kali hidroxit )

Kali hydroxit còn được gọi là dung dịch kiềm, còn được gọi là kali ăn da, nó là một chất nền mạnh được bán trên thị trường ở nhiều dạng gồm có viên , mảnh và bột. Nó được sử dụng trong những ứng dụng hóa chất, công nghiệp và sản xuất rất khác nhau. Bên cạnh đó, kali hydroxit được sử dụng trong thực phẩm để điều chỉnh độ pH, làm chất ổn định và làm chất đặc. kali hydroxit còn được sử dụng để sản xuất xà phòng, làm chất điện phân trong pin kiềm và xi mạ điện, in thạch bản, tẩy sơn và véc ni. Chất tẩy rửa cống lỏng chứa 25 đến 36% kali hydroxit. Về mặt y học, kali hydroxit (KOH) được sử dụng rộng rãi trong việc sẵn sàng sẵn sàng giá thể ướt của những bệnh phẩm lâm sàng rất khác nhau để quan sát bằng kính hiển vi của nấm và những yếu tố vi nấm trong da, tóc, móng tay và thậm chí cả dịch tiết âm đạo. Gần đây, nó đã được nghiên cứu và phân tích về hiệu suất cao và kĩ năng dung nạp trong điều trị mụn cóc.
1. Chất tẩy rửa
Để sử dụng kali hydroxit làm chất tẩy rửa, nó cần phải kết phù phù hợp với những chất hoạt động và sinh hoạt giải trí mặt phẳng và những nguồn kiềm khác trước đây khi hòa tan vào nước. Chất lỏng hoặc chất rắn tạo thành hoàn toàn có thể được sử dụng để vô hiệu hầu hết những chất gây ô nhiễm khỏi nhiều loại mặt phẳng. Nó hoạt động và sinh hoạt giải trí bằng phương pháp hạ thấp sức căng mặt phẳng của dung dịch, tách chất gây ô nhiễm khỏi mặt phẳng và tạo thành nhũ tương. Các chất hoạt động và sinh hoạt giải trí mặt phẳng có một đầu hòa tan trong nước (ưa nước) và một đầu hòa tan trong dầu (kỵ nước), tạo ra nhũ tương dầu nước dễ rửa trôi.
Điều quan trọng cần lưu ý là nồng độ kali hydroxit phải thay đổi tùy thuộc vào mặt phẳng được làm sạch. Ví dụ, mặt phẳng thép, gang và thép không gỉ hoàn toàn có thể xử lý nồng độ cao hơn mức được khuyến nghị cho những mặt phẳng sắt kẽm kim loại tổng hợp tương đối 'mềm' như nhôm, đồng và đồng thau.
 Để sử dụng kali hydroxit làm chất tẩy rửa, nó cần phải kết phù phù hợp với những chất hoạt động và sinh hoạt giải trí mặt phẳng và những nguồn kiềm khác trước đây khi hòa tan vào nước.
Để sử dụng kali hydroxit làm chất tẩy rửa, nó cần phải kết phù phù hợp với những chất hoạt động và sinh hoạt giải trí mặt phẳng và những nguồn kiềm khác trước đây khi hòa tan vào nước.
Các đặc tính độc đáo của nó làm cho kali hydroxit trở thành một chất làm sạch đa năng và mạnh mẽ và tự tin, mang lại kết quả tuyệt vời cho một loạt những ứng dụng làm sạch. Potassium hydroxide do Vynova sản xuất vì vậy được những thương hiệu sản phẩm tẩy rửa số 1 Châu Âu sử dụng rộng rãi, giúp bạn giữ gìn ngôi nhà đất của tớ trong tình trạng tốt nhất.
2. Chất điện giải
Kali hydroxit trong nước được sử dụng làm chất điện phân trong pin kiềm nhờ vào niken - cadmium , niken - hydro và mangan đioxit - kẽm . Kali hydroxit được ưu tiên hơn natri hydroxit vì dung dịch của nó dẫn điện hơn. Các pin nickel-metal hydride trong Toyota Prius sử dụng một hỗn hợp của kali hydroxit và natri hydroxit. Pin niken-sắt cũng sử dụng chất điện phân kali hydroxit.
3. Công nghiệp thực phẩm
Trong những sản phẩm thực phẩm, kali hydroxit hoạt động và sinh hoạt giải trí như một chất làm đặc thực phẩm, chất trấn áp độ pH và chất ổn định thực phẩm. Các FDA xem xét nó (như thể một thành phần thức ăn cho những người dân trực tiếp) như thường bảo vệ an toàn và đáng tin cậy khi kết phù phù hợp với "tốt" sản xuất điều kiện hành nghề sử dụng. [19] Nó được nghe biết trong khối mạng lưới hệ thống số E là E525 .
4. Một số ứng dụng khác
Giống như natri hydroxit, kali hydroxit thu hút nhiều ứng dụng chuyên biệt, hầu như tất cả đều nhờ vào những đặc tính của nó như một cơ sở hóa học mạnh với kĩ năng làm phân hủy nhiều vật liệu do đó. Ví dụ, trong một quá trình thường được gọi là "hỏa táng hóa học" hoặc " thay thế ", kali hydroxit đẩy nhanh quá trình phân hủy những mô mềm, cả động vật và con người, chỉ để lại xương và những mô cứng khác. Các nhà côn trùng nhỏ học muốn nghiên cứu và phân tích cấu trúc tốt của giải phẫu côn trùng nhỏ hoàn toàn có thể sử dụng dung dịch nước 10% KOH để áp dụng quy trình này.
Trong tổng hợp hóa học, sự lựa chọn giữa việc sử dụng KOH và sử dụng NaOH được định hướng bởi độ hòa tan hoặc giữ chất lượng của muối tạo thành .
Đặc tính ăn mòn của kali hydroxit làm cho nó trở thành một thành phần hữu ích trong những chất và chế phẩm làm sạch và khử trùng những mặt phẳng và vật liệu hoàn toàn có thể chống lại sự ăn mòn của KOH.
KOH cũng khá được sử dụng để sản xuất chip bán dẫn. Xem thêm: khắc ướt dị hướng.
Potassium hydroxide thường là thành phần hoạt động và sinh hoạt giải trí chính trong hóa chất "tẩy lớp biểu bì" được sử dụng trong điều trị làm móng .
Vì những chất bazơ mạnh như KOH làm hỏng lớp biểu bì của sợi tóc , nên kali hydroxit được sử dụng để tương hỗ hóa học vô hiệu lông trên da động vật. Da sống được ngâm vài giờ trong dung dịch KOH và nước để sẵn sàng sẵn sàng cho quá trình lột da của quy trình thuộc da . Tác dụng tương tự này cũng khá được sử dụng để làm yếu tóc của con người để sẵn sàng sẵn sàng cho việc cạo râu. Các sản phẩm cạo râu và một số trong những loại kem cạo râu có chứa kali hydroxit để buộc mở lớp biểu bì tóc và hoạt động và sinh hoạt giải trí như một tác nhân hút ẩm để thu hút và ép nước vào sợi tóc, khiến tóc thêm hư tổn. Ở trạng thái suy yếu này, tóc dễ bị dao cạo cắt hơn.
Kali hydroxit được sử dụng để xác định một số trong những loài nấm . Dung dịch nước 3–5% của KOH được bôi lên thịt của nấm và nhà nghiên cứu và phân tích lưu ý xem màu của thịt có thay đổi hay là không. Một số loài nấm có mang , bo bo , đa bào tử và địa y hoàn toàn có thể nhận dạng được nhờ vào phản ứng thay đổi sắc tố này.
Page 4Nếu chưa thấy hết, hãy kéo sang phải để thấy hết phương trình ==>
Hãy kéo xuống dưới để xem điều kiện phản ứng
và Download Đề Cương Luyện Thi Miễn Phí
Xin hãy kéo xuống dưới để xem và thực hành những thắc mắc trắc nghiệm liên quan
☟☟☟
Không tìm thấy thông tin về cách thực hiện phản ứng của phương trình 3N2 + 2O3 => 6NO Bạn tương hỗ update thông tin giúp chúng mình nhé!
Hiện tượng nhận ra 3N2 + 2O3 => 6NO
Phương trình không còn hiện tượng kỳ lạ nhận ra đặc biệt.
Trong trường hợp này, bạn chỉ thường phải quan sát chất sản phẩm NO (nitơ oxit), được sinh ra
Hoặc bạn phải quan sát chất tham gia N2 (nitơ), O3 (ozon), biến mất.
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ N2 (nitơ) ra NO (nitơ oxit)
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ O3 (ozon) ra NO (nitơ oxit)

1. Hợp chất nitơ Phân tử nitơ trong khí quyển là tương đối trơ, nhưng trong tự nhiên nó bị chuyển hóa rất chậm thành những hợp chất có ích về mặt sinh học và công nghiệp nhờ một số trong những khung hình sống, đa phần là những vi khuẩn (xem Vai trò sinh học dưới đây). Khả năng phối hợp hay cố định và thắt chặt nitơ là đặc trưng quan trọng của công nghiệp hóa chất tân tiến, trong đó nitơ (cùng với khí thiên nhiên) được chuyển hóa thành amôniắc (thông qua phương pháp Haber). Amôniắc, trong lượt của tớ, hoàn toàn có thể được sử dụng trực tiếp (đa phần như thể phân bón), hay làm nguyên vật liệu cho nhiều hóa chất quan trọng khác, gồm có thuốc nổ, đa phần thông qua việc sản xuất axít nitric theo phương pháp Ostwald. Các muối của axít nitric gồm có nhiều hợp chất quan trọng như xanpet (hay diêm tiêu- trong lịch sử quả đât nó là quan trọng do được sử dụng để làm thuốc súng) và nitrat amôni, một phân bón hóa học quan trọng. Các hợp chất nitrat hữu cơ khác, ví dụ điển hình trinitrôglyxêrin và trinitrotoluen (tức TNT), được sử dụng làm thuốc nổ. Axít nitric được sử dụng làm chất ôxi hóa trong những tên lửa dùng nhiên liệu lỏng. Hiđrazin và những dẫn xuất của nó được sử dụng làm nhiên liệu cho những tên lửa. 2. Khí nitơ Nitơ dạng khí được sản xuất nhanh gọn bằng phương pháp cho nitơ lỏng (xem dưới đây) ấm lên và bay hơi. Nó có nhiều ứng dụng, gồm có cả việc phục vụ như thể sự việc thay thế trơ hơn cho không khí khi mà sự ôxi hóa là không mong ước.[18] để dữ gìn và bảo vệ tính tươi của thực phẩm đóng gói hay dạng rời (bằng việc làm chậm sự ôi thiu và những dạng tổn thất khác gây ra bởi sự ôxi hóa),[19] trên đỉnh của chất nổ lỏng để đảm bảo bảo vệ an toàn và đáng tin cậy Nó cũng khá được sử dụng trong: sản xuất những linh phụ kiện điện tử như tranzito, điốt, và mạch tích hợp (IC). sản xuất thép không gỉ, bơm lốp ô tô và máy bay do tính trơ và sự thiếu những tính chất ẩm, ôxi hóa của nó, ngược lại với không khí (tuy nhiên điều này là không quan trọng và thiết yếu đối với ô tô thông thường trái lại với một số trong những ý kiến, nitơ thẩm thấu qua lốp cao su không chậm hơn không khí. Không khí là hỗn hợp đa phần chứa nitơ và ôxy (trong dạng N2 và O2), và những phân tử nitơ là nhỏ hơn. Trong những điều kiện tương đương thì những phân tử nhỏ hơn sẽ thẩm thấu qua những vật liệu xốp nhanh hơn. Một ví dụ khác về tính đa dụng của nó là việc sử dụng nó (như thể một chất thay thế được ưa chuộng cho điôxít cacbon) để tạo áp lực cho những thùng chứa một số trong những loại bia,[21] rõ ràng là bia đen có độ cồn cao và bia ale của Anh và Scotland, do nó tạo ra ít bọt hơn, điều này làm cho bia nhuyễn và nặng hơn. Một ví dụ khác về việc nạp khí nitơ cho bia ở dạng lon hay chai là bia tươi Guinness. 3. Nitơ lỏng Nitơ hóa lỏng. Nitơ lỏng được sản xuất theo quy mô công nghiệp với một lượng lớn bằng phương pháp chưng cất phân đoạn không khí lỏng và nó thường được nói đến theo công thức giả LN2. Nó là một tác nhân làm lạnh (cực lạnh), hoàn toàn có thể làm cứng ngay lập tức những mô sống khi tiếp xúc với nó. Khi được cách ly thích hợp khỏi nhiệt của môi trường tự nhiên thiên nhiên xung quanh thì nó phục vụ như thể chất cô đặc và nguồn vận chuyển của nitơ dạng khí mà không cần nén. Ngoài ra, kĩ năng của nó trong việc duy trì nhiệt độ một cách siêu phàm, do nó bay hơi ở 77 K (-196°C hay -320°F) làm cho nó cực kỳ hữu ích trong nhiều ứng dụng rất khác nhau, ví dụ điển hình trong vai trò của một chất làm lạnh quy trình mở, gồm có: làm lạnh để vận chuyển thực phẩm dữ gìn và bảo vệ những bộ phận thân thể cũng như những tế bào tinh trùng và trứng, bộ sưu tập và chế phẩm sinh học. trong nghiên cứu và phân tích những tác nhân làm lạnh để minh họa trong giáo dục trong da liễu học để vô hiệu những tổn thương da ác tính xấu xí hay tiềm năng gây ung thư, ví dụ những mụn cóc, những vết chai sần trên da v.v.[24] Nitơ lỏng hoàn toàn có thể sử dụng như thể nguồn làm mát để tăng tốc CPU, GPU, hay những dạng phần cứng khác. Nitơ lỏng là nitơ ở trạng thái lỏng, nhiệt độ của nó rất là thấp khoảng chừng -196 độ C, ở nhiệt độ này thì bạn cũng biết nó hoàn toàn có thể phá hủy mọi thứ liên quan đến khung hình sống. Nitơ là một trong nhiều chủng loại khí công nghiệp và có ứng dụng rộng rãi, là khí trơ, không màu, không mùi, không độc hại, không khiến cháy và nổ. Nitơ lỏng có trọng lượng riêng là 0,807g/ml và có hằng số điện môi là một trong,4. Số nguyên tử của nó là 7. Nitơ chiếm 78% trong bầu khí quyển, nitơ lỏng được nén lại bằng phương pháp chưng cất phân đoạn không khí => thu được nitơ long và oxi lỏng => Các khí nitơ lỏng nào sẽ được đưa vào thùng chứa và đưa vào sử dụng trong công nghiệp Các khí nitơ này đưa vào công nghiệp sẽ có khối mạng lưới hệ thống giàn hóa hơi biến khí Nitơ long này trở lại thành khí Nitơ thông thường Sau khi qua giàn hóa hơi nitơ được hóa hơi sẽ đưa qua những van áp để phân chia vào công nghiệp Nitơ lỏng được ứng dụng trong hằng trăm nghành kể không bao giờ hết cả, từ nghành thực phẩm đến nghành dệt nhuôm và còn rất nhiều nghành khác.

1. Sử dụng trong công nghiệp Ôzôn được sử dụng để tẩy trắng đồ vật và tiêu diệt vi khuẩn. Rất nhiều khối mạng lưới hệ thống nước sinh hoạt công cộng sử dụng ôzôn để khử vi khuẩn thay vì sử dụng clo. Ôzôn không tạo thành những hợp chất hữu cơ chứa clo, nhưng chúng cũng không tồn tại trong nước sau khi xử lý, vì thế một số trong những khối mạng lưới hệ thống cho thêm một chút ít clo vào để ngăn cản sự phát triển của vi khuẩn trong đường ống. 2. Trong công nghiệp ôzôn được sử dụng để: Khử trùng nước uống trước khi đóng chai, Khử những chất gây ô nhiễm có trong nước bằng phương pháp hóa học (sắt, asen, sulfua hiđrô, nitrit, và những chất hữu cơ phức tạp link với nhau tạo ra "màu" của nước, Hỗ trợ trong quá trình kết tụ (là quá trình kết tụ của những phân tử, được sử dụng trong quá trình lọc để vô hiệu sắt và asen), Làm sạch và tẩy trắng vải (việc sử dụng để tẩy trắng được cấp bằng sáng chế), Hỗ trợ trong gia công chất dẻo (plastic) để được cho phép mực kết dính, Đánh giá tuổi thọ của mẫu cao su để xác định chu kỳ luân hồi tuổi thọ của tất cả lô cao su. Sử dụng trong y tế Ôzôn, cùng với những ion hypoclorit, được sản xuất tự nhiên bởi những tế bào máu trắng (bạch cầu) cũng như rễ của cây cúc vạn thọ như thể phương pháp để tiêu diệt những vật thể lạ. Khi ôzôn phân rã nó tạo thành những gốc tự do của ôxy, là những chất có hoạt tính cao và gây nguy hiểm hay tiêu diệt phần lớn những phân tử hữu cơ. Ôzôn được sử dụng trong một số trong những trường hợp trong y tế. Nó hoàn toàn có thể được sử dụng để ảnh hưởng tới cân đối chống ôxi hóa-tương hỗ ôxi hóa của khung hình, khi đó thông thường khung hình sẽ phản ứng với sự hiện hữu của nó bằng phương pháp sản sinh ra những enzym chống ôxi hóa. Liệu pháp ôzôn được sử dụng trong y học thử nghiệm, việc này đang gây ra nhiều nghi vấn do nó không được nghiên cứu và phân tích và kiểm nghiệm một cách khoa học và thận trọng. Liệu pháp này là nguy hiểm chính bới ôzôn là một chất ăn mòn rất mạnh. Tại Mỹ, liệu pháp ôzôn là phạm pháp, vì FDA vẫn không được cho phép thử nghiệm nó trên người. Ít nhất đã có một người chết vì sử dụng nó tại Mỹ. Các máy "làm sạch không khí" để sản xuất "ôxy hoạt hóa", tức ôzôn, vẫn được bày bán trên thị trường Mỹ. Ôzôn được tìm thấy để quy đổi cholesteron trong máu thành cục (làm cứng và hẹp những động mạch). Sản phẩm cholesteron này cũng gây ra bệnh Alzheimer. Ôzôn được nghiên cứu và phân tích rất nhiều và nó bị xem là chất gây ung thư cho một số trong những động vật (số khác thì không), cũng như thể tác nhân gây đột biến ở một số trong những vi khuẩn.

Hỗn hợp Nitric oxit với oxy được sử dụng để chăm sóc đặc biệt để thúc đẩy sự giãn nở của mao mạch và phổi để điều trị cao huyết áp ban đầu ở bệnh nhân sơ sinh[1][Cần cập nhật][2] Và những bệnh hô hấp có liên quan đến dị tật bẩm sinh. Đây thường là giải pháp ở đầu cuối trước khi sử dụng oxy hóa màng ngoài khung hình (ECMO). Liệu pháp nitric oxit có tiềm năng làm tăng đáng kể xác suất sinh tồn, và trong một số trong những trường hợp, cứu sống trẻ sơ sinh có rủi ro tiềm ẩn tiềm ẩn bị bệnh mạch phổi. Ngoài ra NO còn là một nguyên vật liệu sản xuất axit nitric, citric, muối nitrat, citrat,...
Page 5
Nếu chưa thấy hết, hãy kéo sang phải để thấy hết phương trình ==>
Hãy kéo xuống dưới để xem điều kiện phản ứng
và Download Đề Cương Luyện Thi Miễn Phí
Xin hãy kéo xuống dưới để xem và thực hành những thắc mắc trắc nghiệm liên quan
☟☟☟
Phân loại của phương trình Fe + CuSO4 => Cu + FeSO4
Phương Trình Hoá Học Lớp 9 Phương Trình Hoá Học Lớp 10 Phản ứng oxi-hoá khử Phản ứng thế
Cho đinh sắt vào dung dịch CuSO4
Hiện tượng nhận ra Fe + CuSO4 => Cu + FeSO4
Chất rắn white color xám Sắt (Fe) bị 1 lớp đỏ đồng Cu phủ lên mặt phẳng.
tin tức thêm
Kết luận sắt hoạt động và sinh hoạt giải trí hoá học manh hơn đồng
Phương Trình Điều Chế Từ Fe Ra Cu
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ Fe (sắt) ra Cu (đồng)
Phương Trình Điều Chế Từ Fe Ra FeSO4
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ Fe (sắt) ra FeSO4 (Sắt(II) sunfat)
Phương Trình Điều Chế Từ CuSO4 Ra Cu
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ CuSO4 (Đồng(II) sunfat) ra Cu (đồng)
Phương Trình Điều Chế Từ CuSO4 Ra FeSO4
Trong thực tế, sẽ hoàn toàn có thể nhiều hơn nữa 1 phương pháp điều chế từ CuSO4 (Đồng(II) sunfat) ra FeSO4 (Sắt(II) sunfat)

Sắt là sắt kẽm kim loại được sử dụng nhiều nhất, chiếm khoảng chừng 95% tổng khối lượng sắt kẽm kim loại sản xuất trên toàn thế giới. Sự phối hợp của giá tiền thấp và những đặc tính tốt về chịu lực, độ dẻo, độ cứng làm cho nó trở thành không thể thay thế được, đặc biệt trong những ứng dụng như sản xuất ô tô, thân tàu thủy lớn, những bộ khung cho những khu công trình xây dựng xây dựng. Thép là sắt kẽm kim loại tổng hợp nổi tiếng nhất của sắt, ngoài ra còn tồn tại một số trong những hình thức tồn tại khác của sắt như: Gang thô (gang lợn) chứa 4% – 5% cacbon và chứa một loạt những chất khác ví như lưu huỳnh, silic, phốt pho. Đặc trưng duy nhất của nó: nó là bước trung gian từ quặng sắt sang thép cũng như nhiều chủng loại gang đúc (gang trắng và gang xám). Gang đúc chứa 2% – 3.5% cacbon và một lượng nhỏ mangan. Các chất có trong gang thô có ảnh hưởng xấu đến những thuộc tính của vật liệu, như lưu huỳnh và phốt pho ví dụ điển hình sẽ bị khử đến mức hoàn toàn có thể đồng ý được. Nó có điểm nóng chảy trong khoảng chừng 1420–1470 K, thấp hơn so với cả hai thành phần chính của nó, làm cho nó là sản phẩm đầu tiên bị nóng chảy khi cacbon và sắt được nung nóng cùng nhau. Nó rất rắn, cứng và dễ vỡ. Làm việc với đồ vật bằng gang, thậm chí khi nóng trắng, nó có xu hướng phá vỡ hình dạng của vật. Thép carbon chứa từ 0,5% đến 1,5% cacbon, với một lượng nhỏ mangan, lưu huỳnh, phốt pho và silic. Sắt non chứa ít hơn 0,5% cacbon. Nó là sản phẩm dai, dễ uốn, rất khó nóng chảy như gang thô. Nó có rất ít cacbon. Nếu mài nó thành lưỡi sắc, nó đánh mất tính chất này rất nhanh. Các loại thép sắt kẽm kim loại tổng hợp chứa những lượng rất khác nhau của cacbon cũng như những sắt kẽm kim loại khác, như crôm, vanađi, môlipđen, niken, vonfram, v.v. Ôxít sắt (III) được sử dụng để sản xuất những bộ lưu từ tính trong máy tính. Chúng thường được trộn lẫn với những hợp chất khác, và bảo tồn thuộc tính từ trong hỗn hợp này. Trong sản xuất xi măng người ta trộn thêm Sunfat Sắt vào để hạn chế tác hại của Crom hóa trị 6-nguyên nhân chính gây ra bệnh dị ứng xi măng với những người dân thường xuyên tiếp xúc với nó

Một lượng lớn đồng(II) sunfat pentahydrat được sản xuất ra để sử dụng trong nông nghiệp với vai trò là kháng nấm bệnh. Vì vậy, nó là thành phần quan trọng trong thuốc diệt cỏ, diệt nấm và trừ sâu. Đồng thời, nó giúp tương hỗ update vi lượng Cu khi cây bị thiếu. Nó có ảnh hưởng đến quá trình sinh lý, sinh hóa của cây như giúp khử nitrat, phân giải, khử CO2, thoát hơi nước, chuyển hóa gluxit, tạo những mô mới thân lá rễ và ảnh hưởng đến tính chịu hạn, chịu lạnh, chịu nóng của cây. Đồng(II) sunfat pentahydrat cũng luôn có thể có tác động đến sự tổng hợp nhiều loại chất đường bột, hợp chất có đạm, chất béo, clorofin, vitamin C, enzym và những sắc tố khác cho tất cả động vật và thực vật. Đồng(II) sunfat pentahydrat còn được sử dụng là nguyên vật liệu thức ăn chăn nuôi. Việc tương hỗ update đồng nhằm mục đích điều chỉnh lại sự thiếu đồng trong khung hình vật nuôi, đặc biệt là chất điều hòa sinh trưởng cho lợn và gà. Từ đó kích thích tăng trưởng cho lợn, gà để tăng năng suất và giá trị kinh tế tài chính. Phèn xanh trong ao tôm được tạo ra từ đồng(II) sunfat pentahydrat đóng vai trò quan trọng trong quá trình lột xác và sinh sản. Nó giúp tương hỗ quá trình chuyển máu và hô hấp của tôm ra mắt thuận lợi hơn. Ngoài nông nghiệp, đồng(II) sunfat pentahydrat cũng khá được ứng dụng trong công nghiệp xử lý nước thải, dệt nhuộm, tạo màu. Ngoài ra, còn được dùng nhiều trong ngành công nghiệp lọc sắt kẽm kim loại và sơn tàu thuyền.
Đồng là vật liệu dễ dát mỏng dính, dễ uốn, hoàn toàn có thể dẫn điện và dẫn nhiệt tốt, vì vậy nó được sử dụng một cách rộng rãi trong sản xuất những sản phẩm: Dây điện. Que hàn đồng. Tay nắm và những đồ vật khác trong xây dựng nhà cửa. Đúc tượng: Ví dụ tượng Nữ thần Tự Do, chứa 81,3 tấn (179.200 pound) đồng sắt kẽm kim loại tổng hợp. Cuộn từ của nam châm hút điện. Động cơ, đặc biệt là những động cơ điện. Động cơ hơi nước của Watt. Rơ le điện, dây dẫn điện Một trong những bảng mạch và những chuyển mạch điện. Ống chân không, ống tia âm cực và magnetron trong những lò vi ba. Bộ dẫn sóng cho những bức xạ vi ba. Việc sử dụng đồng trong những mạch IC đã trở nên phổ biến hơn để thay thế cho nhôm vì độ dẫn điện cao của nó. Là một thành phần trong tiền sắt kẽm kim loại. Trong đồ nhà nhà bếp, ví dụ như chảo rán. Phần lớn những đồ dùng bằng niken trắng dùng ở bàn ăn (dao, nĩa, thìa) có chứa một lượng đồng nhất định. Trong sản xuất đồ đựng thức ăn bằng bạc (hàm lượng bạc từ 92,5% trở lên), có chứa một số trong những phần trăm đồng. Là thành phần của gốm sắt kẽm kim loại và thủy tinh màu. Các loại nhạc khí, đặc biệt là nhiều chủng loại nhạc khí từ đồng thau. Làm mặt phẳng tĩnh sinh học trong những bệnh viện hay những bộ phận của tàu thủy để chống hà. Các hợp chất, ví dụ như dung dịch Fehling, có ứng dụng trong phân tích hóa học. Đồng (II) Sulfat được sử dụng như thể thuốc bảo vệ thực vật và chất làm sạch nước. Đồ đồng là những sản phẩm làm từ nguyên vật liệu bằng đồng đúc ví dụ như tượng đồng, tranh đồng, trống đồng... Từ lâu đồ đồng đã được dùng như thể những dụng cụ, đồ vật trang trí trong nhà không thể thiếu của người Việt Nam tất cả chúng ta. Nhất là trong tín ngưỡng, văn hóa dân gian. Từ lâu người Việt đã dùng đồng để làm đồ thờ cúng trong ban thờ gia tiên như: hoành phi câu đối bằng đồng đúc, bộ đồ thờ cúng bằng đồng đúc, đỉnh đồng, lư đồng, hạc đồng... Đồ đồng mỹ nghệ là những sản phẩm mỹ nghệ làm từ đồng ví dụ như: tượng đồng, tranh đồng, trống đồng... Những sản phẩm mỹ nghệ làm từ đồng luôn luôn được ưa chuộng và rất hay được sử dụng trong nhà nhất là tranh đồng, tượng đồng Đồ đồng phong thủy là những vật phẩm, thiêng vật, tượng... làm từ đồng. Đồ đồng phong thủy dùng để trấn trạch, hoặc dùng để thỉnh cầu một nguyện vọng nào đó: hóa cát thành hung, giải thoát tai ương, mong ước những điều tốt đẹp nhất đến với mình và mái ấm gia đình mình
FeSO4 (Sắt(II) sunfat )

Sắt(II) sunfat là tên gọi chung của một nhóm muối với công thức hóa học FeSO4·xH2O. Dạng muối phổ biến nhất là dạng ngậm 7 phân tử nước (x = 7) nhưng ngoài ra cũng luôn có thể có nhiều giá trị x rất khác nhau. Muối ngậm nước này được sử dụng trong y tế để điều trị chứng thiếu sắt, và cũng cho những ứng dụng công nghiệp. Được nghe biết từ thời cổ đại với tên gọi coppera và vitriol xanh lá cây, muối ngậm 7 phân tử nước với màu lục lam nhạt là dạng phổ biến nhất của hợp chất này. Tất cả sắt(II) sunfat hòa tan trong nước để tạo ra cùng một aquo phức [Fe(H2O)6]2+, có quy quy mô học phân tử bát diện và thuận từ. Tên copperas có từ thời đồng(II) sunfat được gọi là coppera xanh, và có lẽ rằng tương tự, sắt(II) và kẽm sunfat được nghe biết tương ứng là coppera màu xanh lá cây và coppera trắng. Hợp chất này còn có trong Danh sách những thuốc thiết yếu của WHO, nhiều chủng loại thuốc quan trọng nhất thiết yếu cho một khối mạng lưới hệ thống y tế cơ bản
Bài Tập Trắc Nghiệm Liên Quan
Trong những hiện tượng kỳ lạ thực hành dưới đây, hiện tượng kỳ lạ nào miêu tả không đúng chuẩn.
A. Cho mẩu Na vào dung dịch đựng FeCl3 thấy có khí thoát ra đồng thời có kết tủa màu nâu đỏ. B. Thêm dung dịch NH3 dư vào dung dịch AlCl3 thấy có kết tủa, sục khí CO2 dư vào ống nghiệm chứa kết tủa trên thấy kết tủa tan C. Nhúng lá sắt đã đánh sạch gỉ vào dung dịch CuSO4, lá sắt chuyển sang red color.
D. Thả mẩu kẽm vào hai ống nghiệm đều chứa dung dịch H2SO4. Thêm vào ống nghiệm thứ nhất vài giọt CuSO4 thấy khí thoát ra ở ống nghiệm này nhanh hơn.
Phản ứng điều chế sắt kẽm kim loại nào sau đây thuộc phản ứng thủy luyện?
A. CuO + CO → Cu + CO2 B. 2Al + 3CuO → Al2O3 + 3Cu C. Fe + CuSO4 → Cu + FeSO4
D. CuSO4 + H2O → Cu + 0,5O2 + H2SO4
Dung dịch FeSO4 bị lẫn CuSO4. Phương pháp đơn giản để loại tạp chất là :
A. Cho một lá nhôm vào dung dịch B. Cho lá sắt vào dung dịch C. Cho lá đồng vào dung dịch
D. Cho dung dịch NH3 cho tới dư vào dung dịch, lọc lấy kết tủa Fe(OH)2 rồi hoà tan vào dung dịch H2SO4 loãng.
Nhúng thanh Fe nặng m gam vào 300 ml dung dịch CuSO4 1M, sau thuở nào gian, thu được dung dịch X có chứa CuSO4 0,5M, đồng thời khối lượng thanh Fe tăng 4% so với khối lượng ban đầu. Giả sử thể tích dung dịch không thay đổi và lượng Cu sinh ra bám hoàn toàn vào thanh sắt. Giá trị m là.
A. 24 gam. B. 30 gam. C. 32 gam.
D. 48 gam.
Cho m gam bột Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và 9,2 gam chất rắn Y. Giá trị của m là
A. 5,6. B. 8,4. C. 11,2.
D. 2,8.
Kim loại sắt tác dụng với dung dịch nào sau đây tạo ra muối sắt (II) ?
A. HNO3 đặc nóng, dư B. MgSO4 C. CuSO4
D. H2SO4 đặc nóng, dư
Dung dịch FeSO4 bị lẫn CuSO4. Phương pháp đơn giản để loại tạp chất là:
A. Cho dung dịch NH3 cho tới dư vào dung dịch, lọc lấy kết tủa Fe(OH)2 rồi hòa tan vào dung dịch H2SO4 loãng. B. Cho một lá nhôm vào dung dịch. C. Cho lá đồng vào dung dịch.
D. Cho lá sắt vào dung dịch.
Nhúng một thanh sắt (dư) vào 100ml dung dịch CuSO4 x mol/l. Sau khi những phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt tăng 0,4 gam. Biết tất cả Cu sinh ra đều bám vào thanh sắt. Giá trị của x là:
A. 0,0500 B. 0,5000 C. 0,6250
D. 0,0625
Kim loại sắt tác dụng với dung dịch nào sau đây tạo ra muối sắt (II) ?
A. HNO3 đặc nóng, dư B. MgSO4 C. CuSO4
D. H2SO4 đặc nóng, dư
Dung dịch muối không phản ứng với Fe là :
A. AgNO3. B. CuSO4. C. MgCl2.
D. FeCl3.
Nhúng một thanh sắt (dư) vào 100ml dung dịch CuSO4 x mol/l. Sau khi những phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt tăng 0,4 gam. Biết tất cả Cu sinh ra đều bám vào thanh sắt. Giá trị của x là:
A. 0,05 B. 0,5 C. 0,625
D. 0,0625
Kim loại nào sau đây không khử được ion Cu2+ trong dung dịch CuSO4 thành Cu?
A. Al. B. Mg. C. Fe.
D. K.
Nhúng thanh Fe vào dung dịch CuSO4. Sau thuở nào gian, quan sát thấy hiện tượng kỳ lạ gì?
A. Thanh Fe có white color và dung dịch nhạt dần màu xanh. B. Thanh Fe có red color và dung dịch nhạt dần màu xanh. C. Thanh Fe có trắng xám và dung dịch nhạt dần màu xanh.
D. Thanh Fe có red color và dung dịch dần có màu xanh.
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi những phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
A. 3,84. B. 2,32. C. 1,68.
D. 0,64.
Tiến hành những thí nghiệm sau: - Thí nghiệm 1: Cho thanh Fe vào dung dịch H2SO4 loãng. - Thí nghiệm 2: Nhúng thanh Fe vào dung dịch H2SO4 loãng có thêm vài giọt dung dịch CuSO4. - Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3. - Thí nghiệm 4: Nhúng thanh Fe vào dung dịch FeCl3. Số trường hợp ăn mòn điện hóa là:
A. 2 B. 1 C. 4
D. 3
Tiến hành bốn thí nghiệm sau :
- Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3
- Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl
Số trường hợp xuất hiện ăn mòn điện hoá học là:
A. 2 B. 1 C. 4
D. 3
Chuỗi Phương Trình Hóa Học Liên Quan
Phân Loại Liên Quan
Advertisement
Cập Nhật 2022-04-16 10:56:46pm
[embed]https://www.youtube.com/watch?v=G_gKZFP5iI4[/embed]
