Kinh Nghiệm về Crom và hợp chất của crom bài tập Mới Nhất
Bùi Thị Vân Thiện đang tìm kiếm từ khóa Crom và hợp chất của crom bài tập được Update vào lúc : 2022-04-18 13:48:40 . Với phương châm chia sẻ Bí quyết Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read Post vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Tác giả lý giải và hướng dẫn lại nha.
Crom (Cr) ở ô số 24, thuộc nhóm VIB, chu kì 4 của bảng tuần hoàn.
Nội dung chính- II. Tính chất vật líIII. Tính chất hóa họcIV. Hợp chất của cromCHƯƠNG 2: CACBOHIĐRATCHƯƠNG 3: AMIN. AMINOAXIT VÀ PROTEINCHƯƠNG 4: POLIME VÀ VẬT LIỆU POLIMECHƯƠNG 5: ĐẠI CƯƠNG VỀ KIM LOẠICHƯƠNG 6: KIM LOẠI KIỀM, KIỀM THỔ, NHÔMCHƯƠNG 7: SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNGXem toàn bộ tài liệu Lớp 12: tại đâyVideo liên quan
Cấu hình electron nguyên tử: 1s22s22p63s23p63d54s1viết gọn là [Ar]3d54s1.
II. Tính chất vật lí
Crom có white color ánh bạc, có khối lượng riêng lớn (D = 7,2 g/cm3), nóng chảy ở 1890oC.
Là sắt kẽm kim loại cứng nhất rạch được thủy tinh.
III. Tính chất hóa học
Crom là sắt kẽm kim loại có tính khử mạnh hơn sắt.
Trong phản ứng hóa học, crom tạo nên những hợp chất trong đó crom có số oxi hóa từ +1 đến +6 (thường gặp +2, +3 và +6).
1. Tác dụng với phi kim
Ở nhiệt độ thường, crom chỉ tác dụng với flo. Ở nhiệt độ cao, crom tác dụng với oxi, clo, lưu huỳnh,...
2. Tác dụng với nước
Crom có độ hoạt động và sinh hoạt giải trí hóa học kém Zn và mạnh hơn Fe, nhưng crom bền với nước và không khí do có màng oxit rất mỏng dính, bền bảo vệ. Do đó, người ta mạ crom lên sắt để bảo vệ sắt và dùng crom để chế thép không gỉ.
3. Tác dụng với axit
Vì có màng oxit bảo vệ, crom không tan ngay trong dung dịch axit HCl và H2SO4 loãng và nguội. Khi đun nóng màng oxit tan ra, crom tác dụng với axit giải phóng H và tạo ra muối crom(II) lúc không còn không khí.
Crom không tác dụng với dung dịch axit HNO3 hoặc H2SO4 đặc, nguội.
IV. Hợp chất của crom
1. Hợp chất crom(III)
a, Crom(III) oxit (Cr2O3)
- Là chất rắn, màu lục thẫm, không tan trong nước, dùng tạo màu lục cho đồ sứ, đồ thủy tinh.
- Là oxit lưỡng tính, tan trong dung dịch axit và kiềm đặc.
b, Crom(III) hiđroxit (Cr(OH)3)
- Là chất rắn, màu lục xám, không tan trong nước.
- Là một hiđroxit lưỡng tính, tan được trong dung dịch axit và dung dịch kiềm.
Vì ở trạng thái số oxi hóa trung gian, ion Cr3+ trong dung dịch vừa có tính oxi hóa (trong môi trường tự nhiên thiên nhiên axit) vừa có tính khử (trong môi trường tự nhiên thiên nhiên bazơ).
2. Hợp chất crom(VI)
a, Crom(VI) oxit (CrO3)
- Là chất rắn, red color thẫm.
- Là một oxit axit, tác dụng với nước tạo ra axit. Những axit cromic này sẽ không tách ra được ở dạng tự do mà chỉ tồn tại trong dung dịch.
- Có tính oxi hóa mạnh.
b, Muối crom(VI)
- Khác với những axit cromic và đicromic, những muối cromat và đicromat là những hợp chất bền.
+ Muối cromat là muối của axit cromic, có màu vàng của ion cromat (CrO42-).
+ Muối đicromat là muối của axit đicromic, có màu da cam của ion đicromat (Cr2O72-).
Các muối cromat và đicromat có tính oxi hóa mạnh, đặc biệt trong môi trường tự nhiên thiên nhiên axit, muối crom(VI) bị khử thành muối crom(III).
Trong dung dịch của ion Cr2O72-(màu da cam) luôn luôn có cả ion CrO42-(màu vàng) ở trạng thái cân đối với nhau nên khi thêm dung dịch axit vào muối cromat (màu vàng) sẽ tạo thành đicromat (màu da cam). trái lại khi thêm dung dịch kiềm vào muối đicromat, sẽ tạo thành cromat.
Xem thêm Giải Hóa 12: Bài 34. Crom và hợp chất của crom
Bài 34: Crom và hợp chất của cờ-rôm. Hướng dẫn giải bài 1,2,3, 4,5 trang 155 sgk Hóa học lớp 12.
Mục tiêu: Viết những PTHH thể hiện tính chất của cờ-rôm và hợp chất crom. Tính thể tích hoặc nồng độ dung dịch K2Cr2O7 tham gia phản ứng.
Bài 1. Viết phương trình hóa học của những phản ứng trong dãy chuyển hóa sau: Cr → Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → Cr2O3
4Cr + 3O2 → 2Cr2O3
Cr2O3 + H2SO4 → Cr2(SO4)3 + H2O
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 + 3Na2SO4
2Cr(OH)3 → Cr2O3 + 3H2O
Bài 2. Cấu hình electron của ion Cr3+ là phương án nào?
A.[Ar] 3d5 B.[Ar] 3d4
C.[Ar] 3d3 D.[Ar] 3d2
3. Các số oxi hóa đặc trưng của c-rom là phương án nào?
A. +2, +4, +6. B. +2, +3, +6.
C. +1, +2, +4, +6. D. +3, +4, +6.
4. Hãy viết công thức của một số trong những muối trong đó nguyên tố c-rom
a) Đóng vai trò cation.
b) Có trong thành phần của anion.
Lời giải: Muối mà cờ-rôm đóng vai trò của cation : Cr2(SO4)3, CrCl3, CrSO4
Muối mà cờ-rôm có trong thành phần của anion : K2Cr2O7, Na2CrO4
Bài 5 trang 155 Hóa 12: Khi nung nóng 2 mol natri đicromat người ta thu được 48 gam O2 và 1 mol c-rom (III) oxit. Hãy viết phương trình hóa học của phản ứng và xem xét natri đicromat đã bị nhiệt phân hoàn toàn chưa?
HDG: 2Na2Cr2O7 → 2Na2O + 2Cr2O3 + 3O2
Số mol O2 là nO2 = 48 / 32 = 1,5(mol)
Số mol Na2Cr2O7 nNa2Cr2O7= 23 x nO2 = 1(mol)
Nung 2 mol Na2Cr2O7 nếu thu 48 gam O2 thì chỉ nung hết 1 (mol). Do đó phản ứng chưa kết thúc.
Giải bài 31 hóa học 12: Sắt
Giải bài 32 hóa học 12: Hợp chất của sắt
Giải bài 33 hóa học 12: Hợp kim của sắt
Giải bài 34 hóa học 12: Crom và hợp chất của crom
Giải bài 35 hóa học 12: Đồng và hợp chất của đồng
Giải bài 36 hóa học 12: Sơ lược về niken, kẽm, chì, thiếc
Page 2
CHƯƠNG 2: CACBOHIĐRAT
CHƯƠNG 3: AMIN. AMINOAXIT VÀ PROTEIN
CHƯƠNG 4: POLIME VÀ VẬT LIỆU POLIME
CHƯƠNG 5: ĐẠI CƯƠNG VỀ KIM LOẠI
CHƯƠNG 6: KIM LOẠI KIỀM, KIỀM THỔ, NHÔM
CHƯƠNG 7: SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
Xem toàn bộ tài liệu Lớp 12: tại đây
- Sách giáo khoa hóa học lớp 12
Sách giáo khoa hóa học nâng cao lớp 12
Giải Hóa Học Lớp 12 Nâng Cao
Giải Sách Bài Tập Hóa Lớp 12
Sách Giáo Viên Hóa Học Lớp 12
Sách Giáo Viên Hóa Học Lớp 12 Nâng Cao
Sách Bài Tập Hóa Học Lớp 12
Sách Bài Tập Hóa Học Lớp 12 Nâng Cao
Giải Bài Tập Hóa Học 12 – Bài 34: Crom và hợp chất của crom giúp HS giải bài tập, đáp ứng cho những em một khối mạng lưới hệ thống kiến thức và kỹ năng và hình thành thói quen học tập thao tác khoa học, làm nền tảng cho việc phát triển năng lực nhận thức, năng lực hành vi:
Bài 1 (trang 155 SGK Hóa 12): Viết phương trình hóa học của những phản ứng trong dãy chuyển hóa sau:Cr → Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → Cr2O3
Lời giải:
(1) 4Cr + 3O2 → 2Cr2O3
(2) Cr2O3 + 3H2SO4 → Cr2(SO4)3 + 3H2O
(3) Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 + 3Na2SO4
(4) 2Cr(OH)3 → Cr2O3 + 3H2O
Bài 2 (trang 155 SGK Hóa 12): Cấu hình electron của ion Cr3+ là phương án nào?
A.[Ar] 3d5
B.[Ar] 3d4
C.[Ar] 3d3
D.[Ar] 3d2
Lời giải:
Đáp án C.
Cấu hình e của Cr là: [Ar]3d54s1
⇒ Cấu hình e của Cr3+ là: [Ar]3d3
Bài 3 (trang 155 SGK Hóa 12): Các số oxi hóa đặc trưng của crom là phương án nào?
A. +2, +4, +6.
B. +2, +3, +6.
C. +1, +2, +4, +6.
D. +3, +4, +6.
Lời giải:
Đáp án B.
Bài 4 (trang 155 SGK Hóa 12): Hãy viết công thức của một số trong những muối trong đó nguyên tố crom
a) Đóng vai trò cation.
b) Có trong thành phần của anion.
Lời giải:
Muối mà crom đóng vai trò của cation : Cr2(SO4)3, CrCl3, CrSO4
Muối mà crom có trong thành phần của anion : K2Cr2O7, Na2CrO4
Bài 5 (trang 155 SGK Hóa 12): Khi nung nóng 2 mol natri đicromat người ta thu được 48 gam O2 và 1 mol crom (III) oxit. Hãy viết phương trình hóa học của phản ứng và xem xét natri đicromat đã bị nhiệt phân hoàn toàn chưa?
Lời giải:
2Na2Cr2O7 → 2Na2O + 2Cr2O3 + 3O2
Số mol O2 là 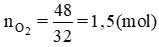
Số mol Na2Cr2O7 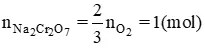
Nung 2 mol Na2Cr2O7 nếu thu 48 gam O2 thì chỉ nung hết 1 (mol). Do đó phản ứng chưa kết thúc.
[embed]https://www.youtube.com/watch?v=sibW9ieFyZY[/embed]
