Thủ Thuật về Cách tính hiệu ứng nhiệt của phản ứng Mới Nhất
Lê Sỹ Dũng đang tìm kiếm từ khóa Cách tính hiệu ứng nhiệt của phản ứng được Cập Nhật vào lúc : 2022-08-30 08:52:04 . Với phương châm chia sẻ Kinh Nghiệm Hướng dẫn trong nội dung bài viết một cách Chi Tiết 2022. Nếu sau khi Read Post vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Admin lý giải và hướng dẫn lại nha.
Trong nhiệt hóa học, lượng nhiệt Qđược giải phóng hoặc hấp thụ do kết quả của một phản ứng hóa học được gọi là hiệu ứng nhiệt. Các phản ứng toả nhiệt được gọi là tỏa nhiệt (Q.> 0), và với sự hấp thụ nhiệt - thu nhiệt (Q.<0>).
Nội dung chính- Câu hỏi nghiên cứu và phân tích:Tính toán nhiệt phản ứngQuyết định:Các phép tính theo phương trình nhiệt hóaQuyết địnhQuyết địnhVideo liên quan
Trong nhiệt động lực học, tương ứng, quá trình tỏa nhiệt được gọi là tỏa nhiệt và những quá trình hấp thụ nhiệt - thu nhiệt.
Theo hệ quả của định luật đầu tiên của nhiệt động lực học đối với quá trình đẳng tích-đẳng nhiệt, hiệu ứng nhiệt bằng sự thay đổi nội năng của hệ. .
Vì trong nhiệt hóa học, tín hiệu ngược lại được sử dụng đối với nhiệt động lực học, do đó.
Đối với quá trình đẳng tích-đẳng nhiệt, hiệu ứng nhiệt bằng sự thay đổi entanpi của hệ. .
Nếu D H> 0- quá trình ra mắt với sự hấp thụ nhiệt và là thu nhiệt.
Nếu D H< 0 - quá trình này kèm theo sự tỏa nhiệt và là tỏa nhiệt.
Từ định luật đầu tiên của nhiệt động lực học, nó tuân theo Luật Hess:
Hiệu ứng nhiệt của những phản ứng hóa học chỉ phụ thuộc vào dạng và trạng thái của những chất ban đầu và sản phẩm ở đầu cuối mà không phụ thuộc vào con phố chuyển hóa từ trạng thái đầu sang trạng thái ở đầu cuối.
Hệ quả của luật này là quy tắc với những phương trình nhiệt hóa, bạn hoàn toàn có thể thực hiện những phép toán đại số thông thường.
Ví dụ, hãy xem xét phản ứng oxy hóa than thành CO 2.
Quá trình chuyển hóa từ chất ban đầu đến chất ở đầu cuối hoàn toàn có thể được thực hiện bằng phương pháp đốt trực tiếp than thành CO 2:
C (t) + O 2 (g) u003d CO 2 (g).
Hiệu ứng nhiệt của phản ứng này Δ H 1.
Quá trình này hoàn toàn có thể được thực hiện trong hai quá trình (Hình 4). Ở quá trình đầu, cacbon cháy thành CO bằng phản ứng
C (t) + O 2 (g) u003d CO (g),
trên CO thứ hai cháy thành CO 2
CO (t) + O 2 (g) u003d CO 2 (g).
Hiệu ứng nhiệt của những phản ứng này lần lượt là Δ H 2 và Δ H 3.
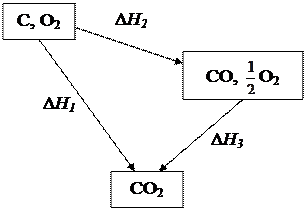
Cơm. 4. Sơ đồ quá trình đốt cháy than thành CO 2
Cả ba quy trình đều được sử dụng rộng rãi trong thực tế. Định luật Hess được cho phép bạn liên hệ những hiệu ứng nhiệt của ba quá trình này bằng phương trình:
Δ H 1=Δ H 2 + Δ H 3.
Hiệu ứng nhiệt của quá trình thứ nhất và thứ ba hoàn toàn có thể được đo tương đối thuận tiện và đơn giản, nhưng việc đốt cháy than thành carbon monoxide ở nhiệt độ cao là rất khó. Hiệu ứng nhiệt của nó hoàn toàn có thể được tính toán:
Δ H 2=Δ H 1 - Δ H 3.
Giá trị H 1 và Δ H 2 phụ thuộc vào loại than được sử dụng. Giá trị Δ H 3 không liên quan đến điều này. Trong quá trình đốt cháy một mol CO ở áp suất không đổi ở 298K, nhiệt lượng là Δ H 3= -283,395 kJ / mol. Δ H 1 u003d -393,86 kJ / mol ở 298K. Sau đó ở 298K Δ H 2 u003d -393,86 + 283.395 u003d -110,465 kJ / mol.
Định luật Hess được cho phép tính toán những hiệu ứng nhiệt của những quá trình không còn tài liệu thực nghiệm hoặc không thể đo được chúng trong những điều kiện thiết yếu. Điều này cũng áp dụng cho những phản ứng hóa học và những quá trình hòa tan, bay hơi, kết tinh, hấp phụ, v.v.
Khi áp dụng định luật Hess, những điều kiện sau đây phải được tuân thủ nghiêm ngặt:
Cả hai tiến trình phải có những trạng thái khởi đầu thực sự giống nhau và những trạng thái kết thúc thực sự giống nhau;
Không chỉ thành phần hóa học của những sản phẩm phải giống nhau, mà còn cả những điều kiện tồn tại của chúng (nhiệt độ, áp suất, v.v.) và trạng thái tập hợp, và đối với những chất kết tinh, sự biến hóa tinh thể.
Khi tính toán hiệu ứng nhiệt của những phản ứng hóa học nhờ vào định luật Hess, người ta thường sử dụng hai loại hiệu ứng nhiệt - nhiệt đốt cháy và nhiệt hình thành.
Sức nóng của giáo dục gọi là hiệu ứng nhiệt của phản ứng tạo hợp chất đã cho từ những chất đơn giản.
Nhiệt do cháyđược gọi là hiệu ứng nhiệt của phản ứng oxi hóa hợp chất đã cho với oxi tạo thành oxit cao hơn của nguyên tố tương ứng hoặc hợp chất của những oxit này.
Các giá trị tham chiếu của hiệu ứng nhiệt và những đại lượng khác thường được quy về trạng thái chuẩn của vật chất.
Như điều kiện tiêu chuẩn những chất lỏng và rắn riêng lẻ có trạng thái của chúng ở một nhiệt độ nhất định và ở áp suất bằng một bầu khí quyển, và đối với những chất khí riêng lẻ, trạng thái của chúng sao cho ở nhiệt độ và áp suất nhất định bằng 1,01 10 5 Pa (1 atm.), Chúng có những tính chất của một khí lý tưởng. Để thuận tiện cho việc tính toán, tham khảo tài liệu tham khảo nhiệt độ tiêu chuẩn 298 K.
Nếu bất kỳ phần tử nào hoàn toàn có thể tồn tại trong một số trong những sửa đổi, thì sửa đổi đó được đồng ý là tiêu chuẩn, nó ổn định ở 298 K và áp suất khí quyển bằng 1,01 10 5 Pa (1 atm.)
Tất cả những đại lượng liên quan đến trạng thái tiêu chuẩn của những chất được đánh dấu bằng một chỉ số trên dưới dạng một vòng tròn:
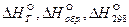 . Trong những quá trình luyện kim, hầu hết những hợp chất được tạo thành với sự giải phóng nhiệt, vì vậy đối với chúng là sự việc ngày càng tăng entanpi. Đối với những phần tử ở trạng thái chuẩn, giá trị.
. Trong những quá trình luyện kim, hầu hết những hợp chất được tạo thành với sự giải phóng nhiệt, vì vậy đối với chúng là sự việc ngày càng tăng entanpi. Đối với những phần tử ở trạng thái chuẩn, giá trị.
Sử dụng tài liệu tham khảo về nhiệt tiêu chuẩn hình thành của những chất tham gia phản ứng, người ta hoàn toàn có thể thuận tiện và đơn giản tính được hiệu ứng nhiệt của phản ứng.
Từ định luật Hess, nó như sau:Hiệu ứng nhiệt của phản ứng bằng hiệu số nhiệt tạo thành của tất cả những chất được chỉ ra ở vế phải của phương trình(chất ở đầu cuối hoặc sản phẩm phản ứng) , và sự hình thành nóng của tất cả những chất được chỉ ra ở phía bên trái của phương trình(nguyên vật liệu ban đầu) , lấy với những thông số bằng những thông số đứng trước công thức của những chất này trong phương trình phản ứng:
ở đâu N- số mol chất tham gia phản ứng.
Ví dụ. Hãy tính hiệu ứng nhiệt của phản ứng Fe 3 O 4 + CO = 3FeO + CO 2. Đun nóng tạo thành những chất tham gia phản ứng là: đối với Fe 3 O 4, đối với CO, đối với FeO, đối với CO 2.
Hiệu ứng nhiệt của phản ứng:
Vì phản ứng ở 298K là phản ứng thu nhiệt, tức là đi cùng với sự hấp thụ nhiệt.
Cũng in như một trong những đặc điểm thể chất của con người là sức mạnh thể chất, đặc tính quan trọng nhất của bất kỳ link hóa học nào là độ bền của link, tức là nghị lực của cô ấy.
Hãy nhớ lại rằng năng lượng của link hóa học là năng lượng được giải phóng trong quá trình hình thành link hóa học hoặc năng lượng nên phải sử dụng để phá hủy link này.
Nói chung, phản ứng hóa học là sự việc biến hóa chất này thành chất khác. Do đó, trong quá trình phản ứng hóa học, một số trong những link bị phá vỡ và những link khác được hình thành, tức là quy đổi năng lượng.
Định luật vật lý cơ bản nói rằng năng lượng không sinh ra từ hư không và không biến mất không dấu vết, mà chỉ truyền từ dạng này sang dạng khác. Do tính phổ biến của nó, nguyên tắc này hiển nhiên áp dụng cho một phản ứng hóa học.
Hiệu ứng nhiệt của một phản ứng hóa học được gọi là nhiệt lượng
giải phóng (hoặc hấp thụ) trong quá trình phản ứng và quy về 1 mol chất đã phản ứng (hoặc được tạo thành).
Hiệu ứng nhiệt được ký hiệu bằng chữ Q. và thường được đo bằng kJ / mol hoặc kcal / mol.
Nếu phản ứng xảy ra với sự tỏa nhiệt (Q.> 0), nó được gọi là tỏa nhiệt, và nếu với sự hấp thụ nhiệt (Q.< 0) – эндотермической.
Nếu tất cả chúng ta mô tả sơ đồ năng lượng của phản ứng, thì đối với phản ứng thu nhiệt, sản phẩm có năng lượng cao hơn chất phản ứng, và đối với phản ứng tỏa nhiệt, ngược lại, sản phẩm phản ứng có năng lượng thấp hơn (ổn định hơn) so với chất phản ứng. .
Rõ ràng là vật chất càng phản ứng, thì năng lượng được giải phóng (hoặc hấp thụ) càng nhiều, tức là hiệu ứng nhiệt tỉ lệ thuận với lượng chất. Do đó, việc gán hiệu ứng nhiệt cho một mol chất là vì tất cả chúng ta muốn so sánh hiệu ứng nhiệt của những phản ứng với nhau.
Bài giảng 6. Hóa nhiệt học. Hiệu ứng nhiệt của phản ứng hóa học Ví dụ 1. Trong quá trình khử 8,0 g đồng (II) oxit bằng hiđro, đồng sắt kẽm kim loại và hơi nước được tạo thành và tỏa ra nhiệt lượng 7,9 kJ. Tính hiệu ứng nhiệt của phản ứng khử đồng (II) oxit.
Quyết định . Phương trình phản ứng CuO (rắn) + H2 (g) = Cu (rắn) + H2 O (g) + Q. (*)
Hãy xác định một tỷ lệ cho việc giảm 0,1 mol - 7,9 kJ được giải phóng; sự phục hồi của một mol - x kJ được giải phóng
Trong số đó x = + 79 kJ / mol. Phương trình (*) trở thành
CuO (rắn) + H2 (g) = Cu (rắn) + H2 O (g) +79 kJ
Phương trình nhiệt hóa- Đây là một phương trình của một phản ứng hóa học, trong đó cho biết thêm thêm trạng thái tập hợp những thành phần của hỗn hợp phản ứng (thuốc thử và sản phẩm) và hiệu ứng nhiệt của phản ứng.
Vì vậy, để làm tan chảy nước đá hoặc nước bay hơi, nên phải tiêu hao một lượng nhiệt nhất định, trong khi khi nước lỏng đóng băng hoặc hơi nước ngưng tụ thì lượng nhiệt đó được giải phóng tương tự. Đó là nguyên do tại sao tất cả chúng ta bị lạnh khi ra khỏi nước (sự bốc hơi nước từ mặt phẳng khung hình cần năng lượng), và đổ mồ hôi là một cơ chế bảo vệ sinh học chống lại khung hình quá nóng. trái lại, ngăn đá sẽ đóng băng nước và làm nóng phòng xung quanh, tạo ra nhiệt lượng dư thừa.
Ví dụ này đã cho tất cả chúng ta biết những hiệu ứng nhiệt của sự việc thay đổi trạng thái kết tụ của nước. Nhiệt của phản ứng tổng hợp (ở 0o C) λ = 3,34 × 105 J / kg (vật lý), hay Qpl. u003d - 6,02 kJ / mol (hóa học), nhiệt bốc hơi (hóa hơi) (ở 100o C) q u003d 2,26 × 106 J / kg (vật lý) hoặc Qisp. u003d - 40,68 kJ / mol (hóa học).
tan chảy
bản mod 298.
Bài giảng 6. Hóa nhiệt học. Hiệu ứng nhiệt của phản ứng hóa học Tất nhiên, quá trình thăng hoa hoàn toàn có thể xảy ra khi chất rắn
đi vào pha khí, bỏ qua trạng thái lỏng và những quá trình ngược lại của kết tủa (kết tinh) từ pha khí, cũng hoàn toàn có thể tính toán hoặc đo lường hiệu ứng nhiệt cho chúng.
Rõ ràng là trong mọi chất đều có link hóa học, do đó, chất nào thì cũng luôn có thể có năng lượng nhất định. Tuy nhiên, không phải tất cả những chất đều hoàn toàn có thể chuyển hóa thành nhau chỉ bằng một phản ứng hóa học. Do đó, chúng tôi đã đồng ý ra mắt một trạng thái tiêu chuẩn.
trạng thái tiêu chuẩn của vật chất là trạng thái tập hợp của một chất ở nhiệt độ 298 K và áp suất 1 khí trong biến hóa dị hướng ổn định nhất trong những điều kiện này.
Điều kiện tiêu chuẩn là nhiệt độ 298 K và áp suất 1 bầu khí quyển. Điều kiện tiêu chuẩn (trạng thái tiêu chuẩn) được ký hiệu bằng chỉ số 0.
Nhiệt tiêu chuẩn hình thành hợp chất được gọi là hiệu ứng nhiệt của phản ứng hóa học tạo thành một hợp chất đã cho từ những chất đơn giản ở trạng thái tiêu chuẩn của chúng. Nhiệt tạo thành hợp chất được ký hiệu là Q. 0 Đối với nhiều hợp chất, độ nóng chuẩn của sự việc hình thành được đưa ra trong những sách tham khảo về đại lượng hóa lý.
Độ nóng tiêu chuẩn của sự việc hình thành những chất đơn giản là 0. Ví dụ, Q0 arr.298 (O2, khí) = 0, Q0 arr.298 (C, rắn, graphit) = 0.
Ví dụ . Viết phương trình nhiệt hóa tạo thành đồng (II) sunfat. Từ sách tham khảo Q0 câu 298 (CuSO4) = 770 kJ / mol.
Cu (s.) + S (s.) + 2O2 (g.) = CuSO4 (s.) + 770 kJ.
Lưu ý: phương trình nhiệt hóa hoàn toàn có thể được viết cho bất kỳ chất nào, nhưng phải hiểu rằng trong thực tế phản ứng xảy ra theo một cách hoàn toàn khác: những oxit của đồng (II) và lưu huỳnh (IV) được tạo thành từ những thuốc thử được liệt kê khi đun nóng, nhưng đồng (II) sunfat không được tạo thành. Một kết luận quan trọng: phương trình nhiệt hóa là một quy mô được cho phép tính toán, nó phù hợp tốt với những tài liệu nhiệt hóa khác, nhưng không chịu được thử nghiệm thực tế (tức là không thể Dự kiến đúng chuẩn kĩ năng xảy ra hoặc không thể xảy ra phản ứng).
(B j) - ∑ a i × Q. arr 0, 298 i
Bài giảng 6. Hóa nhiệt học. Hiệu ứng nhiệt của một phản ứng hóa học
Làm rõ . Để những bạn không hiểu nhầm mình sẽ tương hỗ update ngay phần nhiệt động hóa học đó hoàn toàn có thể Dự kiến kĩ năng / không thể xảy ra phản ứng tuy nhiên, điều này đòi hỏi những “công cụ” tráng lệ hơn vượt ra ngoài phạm vi của một khóa học hóa học ở trường. Phương trình nhiệt hóa so với những phương pháp này là bước đầu tiên chống lại nền của kim tự tháp Cheops - người ta không thể làm mà không còn nó, nhưng người ta không thể vươn cao.
Ví dụ 2. Tính hiệu ứng nhiệt của quá trình ngưng tụ của nước có khối lượng 5,8 g Lời giải. Quá trình ngưng tụ được mô tả bằng phương trình nhiệt hóa H2 O (g.) = H2 O (l.) + Q. - ngưng tụ thường là một quá trình tỏa nhiệt Nhiệt của quá trình ngưng tụ của nước ở 25o C là 37 kJ / mol (sách tham khảo).
Do đó, Q. = 37 × 0,32 = 11,84 kJ.
Vào thế kỷ 19, nhà hóa học người Nga Hess, người đã nghiên cứu và phân tích hiệu ứng nhiệt của những phản ứng, đã thực nghiệm thiết lập định luật bảo toàn năng lượng trong quan hệ với những phản ứng hóa học - định luật Hess.
Hiệu ứng nhiệt của phản ứng hóa học không phụ thuộc vào đường đi của quá trình và chỉ được xác định bằng hiệu số giữa trạng thái cuối và trạng thái đầu.
Theo quan điểm của hóa học và toán học, định luật này nghĩa là tất cả chúng ta hoàn toàn có thể tự do chọn bất kỳ “quỹ đạo tính toán” nào để tính toán quá trình, chính bới kết quả không phụ thuộc vào nó. Vì nguyên do này, luật Hessian rất quan trọng có một hệ quả của luật Hess '.
Hiệu ứng nhiệt của phản ứng hóa học bằng tổng số nhiệt hình thành sản phẩm phản ứng trừ đi tổng nhiệt hình thành chất phản ứng (có tính đến thông số góc).
Theo quan điểm thông thường, hệ quả này tương ứng với một quá trình trong đó tất cả những chất phản ứng đầu tiên được quy đổi thành những chất đơn giản, sau đó được lắp ráp theo một cách mới, để thu được những sản phẩm phản ứng.
Ở dạng phương trình, hệ quả của định luật Hess có dạng như sau Phương trình phản ứng: a 1 A 1 + a 2 A 2 + ... + a n A n = b 1 B 1 + b 2 B 2 + ... b
Trong trường hợp này, a i và b j là thông số cân đối, A i là thuốc thử, B j là sản phẩm phản ứng.
Khi đó hệ quả của định luật Hess có dạng Q. = ∑ b j × Q. arr 0 .298
k Bk + Q.
(A i)
Bài giảng 6. Hóa nhiệt học. Hiệu ứng nhiệt của phản ứng hóa học Vì chất chuẩn nóng lên tạo thành nhiều chất
a) được tóm tắt trong những bảng đặc biệt hoặc b) hoàn toàn có thể được xác định bằng thực nghiệm, sau đó hoàn toàn có thể Dự kiến (tính toán) hiệu ứng nhiệt của một số trong những lượng rất lớn những phản ứng với độ đúng chuẩn đủ cao.
Ví dụ 3. (Hệ quả của định luật Hess '). Tính hiệu ứng nhiệt của quá trình biến hóa hơi metan xảy ra trong pha khí ở điều kiện tiêu chuẩn:
CH4 (g) + H2 O (g) = CO (g) + 3 H2 (g)
Xác định xem phản ứng này tỏa nhiệt hay thu nhiệt?
Giải pháp: Hệ quả của luật Hess '
Q. = 3 Q0
D) + Q. 0
(CO, g) −Q. 0
D) −Q. 0
O, d) - nói chung.
mod, 298
mod, 298
mod, 298
mod, 298
Q. arr0
298 (H 2, g) u003d 0
Một chất đơn giản ở trạng thái tiêu chuẩn của nó
Từ sách tham khảo, chúng tôi tìm thấy sự hình thành nhiệt của những thành phần còn sót lại của hỗn hợp.
O, g) = 241,8
(CO, g) = 110,5
D) = 74,6
mod, 298
mod, 298
mod, 298
Cắm những giá trị vào phương trình
Q. u003d 0 + 110,5 - 74,6 - 241,8 u003d -205,9 kJ / mol, phản ứng tỏa nhiệt mạnh.
Trả lời: Q. u003d -205,9 kJ / mol, thu nhiệt
Ví dụ 4. (Ứng dụng định luật Hess '). Các phản ứng nóng đã biết
C (rắn) + ½ O (g) u003d CO (g) + 110,5 kJ
C (s.) + O2 (g.) = CO2 (g.) + 393,5 kJ Tìm hiệu ứng nhiệt của phản ứng 2CO (g.) + O2 (g.) = 2CO2 (g.) Lời giải Ta nhân với thứ nhất và phương trình thứ hai trên 2
2C (s.) + O2 (g.) U003d 2CO (g.) + 221 kJ 2C (s.) + 2O2 (g.) U003d 2CO2 (g.) + 787 kJ
Trừ phương trình thứ nhất khỏi phương trình thứ hai
O2 (g) = 2CO2 (g) + 787 kJ - 2CO (g) - 221 kJ,
2CO (g) + O2 (g) = 2CO2 (g) + 566 kJ Đáp số: 566 kJ / mol.
Lưu ý: Khi nghiên cứu và phân tích nhiệt hóa học, tất cả chúng ta coi một phản ứng hóa học từ bên phía ngoài (bên phía ngoài). trái lại, nhiệt động lực học hóa học - khoa học về hành vi của những khối mạng lưới hệ thống hóa học - xem xét khối mạng lưới hệ thống từ bên trong và hoạt động và sinh hoạt giải trí với khái niệm "entanpi" H là nhiệt năng của khối mạng lưới hệ thống. enthalpy, vì vậy
Bài giảng 6. Hóa nhiệt học. Hiệu ứng nhiệt của một phản ứng hóa học có cùng ý nghĩa với nhiệt lượng, nhưng có tín hiệu ngược lại: nếu tỏa năng lượng ra khỏi hệ thì môi trường tự nhiên thiên nhiên nhận nó và nóng lên, còn hệ thì mất năng lượng.
Văn chương:
1. sách giáo khoa, V.V. Eremin, N.E. Kuzmenko và những người dân khác, Hóa học lớp 9, đoạn 19,
2. Tài liệu hướng dẫn giáo dục và phương pháp "Cơ bản về Hóa học đại cương" Phần 1.
Tổng hợp bởi S.G. Baram, I.N. Mironov. - mang theo bên mình! cho buổi hội thảo chiến lược tiếp theo
3. A.V. Manuilov. Các nguyên tắc cơ bản của hóa học. ://hemi.nsu.ru/index.htm
§9.1 Hiệu ứng nhiệt của phản ứng hóa học. Các định luật cơ bản của nhiệt hoá học.
§9.2 ** Hóa nhiệt (tiếp theo). Nhiệt hình thành vật chất từ những nguyên tố.
Entanpi chuẩn của sự việc hình thành.
Chú ý!
Chúng tôi đang chuyển sang giải những bài toán tính toán, do đó, Tính từ lúc giờ đây, một chiếc máy tính là mong ước cho những cuộc hội thảo chiến lược về hóa học.
7. Tính hiệu ứng nhiệt của phản ứng ở điều kiện tiêu chuẩn: Fe 2 O 3 (t) + 3 CO (g) u003d 2 Fe (t) + 3 CO 2 (g), nếu nhiệt tạo thành: Fe 2 O 3 (t) u003d - 821,3 kJ / mol; CO (g) = - 110,5 kJ / mol;
CO 2 (g) u003d - 393,5 kJ / mol.
Fe 2 O 3 (t) + 3 CO (g) u003d 2 Fe (t) + 3 CO 2 (g),
Biết hiệu ứng nhiệt tiêu chuẩn của quá trình đốt cháy những chất và sản phẩm phản ứng ban đầu, ta tính được hiệu ứng nhiệt của phản ứng ở điều kiện tiêu chuẩn:
16. Sự phụ thuộc của tốc độ phản ứng hoá học vào nhiệt độ. Quy tắc của Van't Hoff. Hệ số nhiệt độ của phản ứng.
Chỉ có sự va chạm Một trong những phân tử hoạt động và sinh hoạt giải trí mới dẫn đến phản ứng, năng lượng trung bình của phản ứng này vượt quá năng lượng trung bình của những thành phần tham gia phản ứng.
Khi một năng lượng hoạt hóa nhất định E được truyền cho những phân tử (năng lượng dư thừa trên mức trung bình), thế năng tương tác của những nguyên tử trong phân tử giảm, link trong phân tử yếu đi, phân tử trở nên phản ứng.
Năng lượng hoạt hóa không nhất thiết phải được đáp ứng từ bên phía ngoài; nó hoàn toàn có thể được truyền cho một số trong những phần của những phân tử bằng phương pháp phân phối lại năng lượng trong quá trình va chạm của chúng. Theo Boltzmann, trong số N phân tử, số phân tử N hoạt động và sinh hoạt giải trí với năng lượng tăng dần như sau:
N N e - E / RT
trong đó E là năng lượng hoạt hóa, thể hiện mức năng lượng dư thừa thiết yếu so với mức trung bình mà những phân tử phải có để phản ứng hoàn toàn có thể xảy ra; phần còn sót lại của những chỉ định đều được nghe biết.
Trong quá trình hoạt hóa nhiệt ở hai nhiệt độ T 1 và T 2, tỷ số của những hằng số tốc độ sẽ là:
 , (2)
, (2)
 , (3)
, (3)
được cho phép bạn xác định năng lượng hoạt hóa bằng phương pháp đo tốc độ phản ứng ở hai nhiệt độ rất khác nhau T 1 và T 2.
Nhiệt độ tăng 10 0 sẽ làm tăng tốc độ phản ứng lên 2-4 lần (quy tắc van't Hoff gần đúng). Số cho biết thêm thêm tốc độ phản ứng (và do đó là hằng số tốc độ) tăng bao nhiêu lần khi nhiệt độ tăng 10 0 được gọi là thông số nhiệt độ của phản ứng:
 (4)
(4)
 .(5)
.(5)
Điều này nghĩa là, ví dụ, với sự tăng nhiệt độ lên 100 0 để tăng tốc độ trung bình được đồng ý thông thường lên 2 lần ( = 2), thì tốc độ phản ứng tăng lên 2 10, tức là. xấp xỉ 1000 lần, và khi = 4 - 4 10, tức là 1000000 lần. Quy tắc van't Hoff hoàn toàn có thể áp dụng cho những phản ứng xảy ra ở nhiệt độ tương đối thấp trong một phạm vi hẹp. Tốc độ phản ứng tăng mạnh khi nhiệt độ tăng được lý giải là vì số phân tử hoạt động và sinh hoạt giải trí tăng theo cấp số nhân.
25. Phương trình đẳng nhiệt phản ứng hóa học Van't Hoff.
Phù phù phù hợp với quy luật tác động hàng loạt cho một phản ứng tùy ý
và A + bB = cC + dD
Phương trình cho tốc độ của một phản ứng trực tiếp hoàn toàn có thể được viết:
 ,
,
và cho tốc độ của phản ứng ngược:
 .
.
Khi phản ứng tiến hành từ trái sang phải, nồng độ của những chất A và B sẽ giảm và tốc độ của phản ứng thuận giảm. Mặt khác, khi những sản phẩm phản ứng C và D tích tụ, tốc độ phản ứng sẽ tăng từ phải sang trái. Có thuở nào điểm khi tốc độ υ 1 và υ 2 trở nên như nhau, nồng độ của tất cả những chất không thay đổi, do đó,
,Trong số đó K c = k 1 / k 2 =
 .
.
Giá trị không đổi K c, bằng tỷ số Một trong những hằng số tốc độ của phản ứng thuận và phản ứng nghịch, mô tả một cách định lượng trạng thái cân đối thông qua nồng độ cân đối của những chất ban đầu và sản phẩm của tương tác giữa chúng (về thông số cân đối của chúng) và được gọi là hằng số cân đối. Hằng số cân đối chỉ không đổi ở một nhiệt độ nhất định, tức là
K c u003d f (T). Hằng số cân đối của phản ứng hóa học thường được biểu thị bằng một tỷ số, tử số là tích của nồng độ mol cân đối của những sản phẩm phản ứng, và mẫu số là tích nồng độ của những chất ban đầu.
Nếu thành phần của phản ứng là hỗn hợp khí lý tưởng thì hằng số cân đối (K p) được biểu thị bằng áp suất riêng phần của những thành phần:
 .
.
Đối với sự chuyển từ K p sang K với tất cả chúng ta sử dụng phương trình trạng thái P · V = n · R · T. Trong chừng mực
, thì P = C · R · T. .Theo phương trình K p = K s, với điều kiện là phản ứng xảy ra mà không làm thay đổi số mol trong pha khí, tức là lúc (c + d) = (a + b).
Nếu phản ứng xảy ra tự phát ở P và T không đổi hoặc V và T, thì những giá trịG và F của phản ứng này hoàn toàn có thể nhận được từ những phương trình:
 ,
,
trong đó C A, C B, C C, C D là nồng độ không ở trạng thái cân đối của những chất và sản phẩm phản ứng ban đầu.
,trong đó P A, P B, P C, P D là áp suất riêng phần của những chất và sản phẩm phản ứng ban đầu.
Hai phương trình ở đầu cuối được gọi là phương trình đẳng nhiệt phản ứng hóa học van't Hoff. Mối quan hệ này giúp ta hoàn toàn có thể tính giá trị G và F của phản ứng, xác định vị trí hướng của nó ở những nồng độ rất khác nhau của những chất ban đầu.
Cần lưu ý rằng cả đối với hệ khí và dung dịch, với sự tham gia của chất rắn trong phản ứng (tức là đối với hệ dị thể), nồng độ của pha rắn không được gồm có trong biểu thức cho hằng số cân đối, vì nồng độ này thực tế là liên tục. Vì vậy, đối với phản ứng
2 CO (g) u003d CO 2 (g) + C (t)
hằng số cân đối được viết là
.Sự phụ thuộc của hằng số cân đối vào nhiệt độ (đối với nhiệt độ T 2 so với nhiệt độ T 1) được biểu thị bằng phương trình van't Hoff sau:
 ,
,
với Н 0 là hiệu ứng nhiệt của phản ứng.
Đối với phản ứng thu nhiệt (phản ứng xảy ra với sự hấp thụ nhiệt), hằng số cân đối tăng khi nhiệt độ tăng, hệ chống lại sự phát nhiệt.
34. Sự thẩm thấu, áp suất thẩm thấu. Phương trình Van't Hoff và thông số thẩm thấu.
Thẩm thấu là sự việc di tán tự phát của những phân tử dung môi qua màng bán thấm để phân tách những dung dịch có nồng độ rất khác nhau từ dung dịch có nồng độ thấp hơn sang dung dịch có nồng độ cao hơn, dẫn đến sự loãng của dung dịch sau. Là một màng bán thấm, thông qua những lỗ nhỏ mà chỉ những phân tử dung môi nhỏ hoàn toàn có thể đi qua một cách tinh lọc và những phân tử hoặc ion lớn hoặc solvat được giữ lại, màng bóng kính thường được sử dụng - đối với những chất có trọng lượng phân tử cao và đối với trọng lượng phân tử thấp - đồng màng ferrocyanide. Quá trình chuyển dung môi (thẩm thấu) hoàn toàn có thể bị ngăn cản nếu áp suất thủy tĩnh bên phía ngoài được tác dụng vào dung dịch có nồng độ cao hơn (ở điều kiện cân đối, đây sẽ là cái gọi là áp suất thẩm thấu, ký hiệu là chữ ). Để tính giá trị của trong những dung dịch của chất không điện ly, phương trình Van't Hoff thực nghiệm được sử dụng:
trong đó C là nồng độ mol của chất, mol / kg;
R là hằng số khí phổ quát, J / mol K.
Giá trị của áp suất thẩm thấu tỷ lệ với số phân tử (trong trường hợp chung là số hạt) của một hay nhiều chất hòa tan trong một thể tích dung dịch nhất định và không phụ thuộc vào bản chất của chúng và bản chất của dung môi. Trong dung dịch chất điện ly mạnh hay yếu, tổng số hạt riêng biệt tăng lên do sự phân ly của những phân tử, do đó cần đưa thông số tỉ lệ thích hợp, gọi là thông số đẳng áp vào phương trình tính áp suất thẩm thấu.
i C R T,
trong đó i là thông số đẳng tích, được tính bằng tỉ số giữa tổng số ion và số phân tử chất điện li không phân ly với số phân tử ban đầu của chất này.
Vì vậy, nếu mức độ phân ly chất điện ly, tức là tỉ số giữa số phân tử bị phân huỷ thành ion trên tổng số phân tử của chất tan là và phân tử bị điện phân thành n ion thì thông số đẳng tích được tính như sau:
i = 1 + (n - 1) , (i> 1).
Đối với chất điện ly mạnh, bạn hoàn toàn có thể lấy = 1, sau đó i = n, và thông số i (cũng to hơn 1) được gọi là thông số thẩm thấu.
Hiện tượng thẩm thấu có tầm quan trọng lớn đối với những sinh vật thực vật và động vật, vì màng của tế bào của chúng liên quan đến dung dịch của nhiều chất có những đặc tính của màng bán thấm. Trong nước tinh khiết, tế bào trương nở mạnh, một số trong những trường hợp hoàn toàn có thể vỡ vỏ và trong dung dịch có nồng độ muối cao, ngược lại, nó giảm kích thước và co lại do lượng nước mất đi nhiều. Vì vậy, khi dữ gìn và bảo vệ thực phẩm, một lượng lớn muối hoặc đường được thêm vào chúng. Tế bào của vi sinh vật trong điều kiện đó mất một lượng nước đáng kể và chết.
Kết quả của việc nghiên cứu và phân tích chủ đề này, bạn sẽ học được:
- Các phương trình phản ứng hóa học thông thường khác với phương trình nhiệt hóa của chúng ra làm sao. Những yếu tố nào ảnh hưởng đến tốc độ phản ứng hoá học? Cân bằng hóa học thực sự khác với cân đối biểu kiến ra làm sao. Cân bằng chuyển dời theo chiều nào khi điều kiện bên phía ngoài thay đổi. Cơ chế của xúc tác đồng thể và dị thể là gì. Chất ức chế và chất thúc đẩy là gì.
Kết quả của việc nghiên cứu và phân tích chủ đề này, bạn sẽ học được:
- Tính hiệu ứng nhiệt của những phản ứng hóa học bằng phương pháp sử dụng entanpi tạo thành những chất. Thực hiện những phép tính bằng phương pháp sử dụng biểu thức toán học của nguyên tắc van't Hoff. Xác định chiều chuyển dời của cân đối hóa học với sự thay đổi của nhiệt độ và áp suất.
Câu hỏi nghiên cứu và phân tích:
6.1. Năng lượng của những quá trình hóa học
6.1.1. Nội năng và entanpi
Trong bất kỳ quá trình nào, định luật bảo toàn cơ năng được tuân theo:
Q. = ∆U + A.
Đẳng thức này nghĩa là nếu nhiệt lượng Q. được đáp ứng cho hệ thì nhiệt lượng này sẽ được sử dụng để thay đổi nội năng Δ U và để thực hiện công A.
Nội năng hệ là tổng dự trữ của nó, gồm có năng lượng của hoạt động và sinh hoạt giải trí tịnh tiến và quay của phân tử, năng lượng của hoạt động và sinh hoạt giải trí của những electron trong nguyên tử, năng lượng tương tác của hạt nhân với electron, hạt nhân với hạt nhân, v.v., tức là tất cả những dạng năng lượng, trừ động năng và thế năng của toàn hệ.
Công do hệ thực hiện trong quá trình chuyển từ trạng thái 1, có đặc điểm là thể tích V 1, sang trạng thái 2 (thể tích V 2) ở áp suất không đổi (công giãn nở), bằng:
A u003d p (V 2 - V 1).
Ở áp suất không đổi (р = const), có tính đến biểu thức của công giãn nở, định luật bảo toàn năng lượng sẽ được viết như sau:
Q. u003d (U 2 + pV 2) - (U 1 + pV 1).
Tổng nội năng của một hệ và tích của thể tích và áp suất của nó được gọi là enthalpy H:
Vì giá trị đúng chuẩn của nội năng của hệ không xác định được, nên cũng không thể thu được giá trị tuyệt đối của những entanpi. Những thay đổi trong entanpi Δ H có tầm quan trọng về mặt khoa học và có ứng dụng thực tế.
Nội năng U và entanpi H là hiệu suất cao nhà nước những khối mạng lưới hệ thống. Chức năng trạng thái là những đặc điểm như vậy của khối mạng lưới hệ thống, những thay đổi trong đó chỉ được xác định bởi trạng thái ở đầu cuối và trạng thái ban đầu của khối mạng lưới hệ thống, tức là độc lập với đường dẫn quy trình.
6.1.2. Quá trình tỏa nhiệt và thu nhiệt
Dòng phản ứng hóa học đi kèm với sự hấp thụ hoặc giải phóng nhiệt. tỏa nhiệtđược gọi là một phản ứng xảy ra với sự tỏa nhiệt ra môi trường tự nhiên thiên nhiên, và thu nhiệt- với sự hấp thụ nhiệt của môi trường tự nhiên thiên nhiên.
Nhiều quá trình trong công nghiệp và trong phòng thí nghiệm thực tế tiến hành ở áp suất và nhiệt độ không đổi (T = const, p = const). Đặc tính năng lượng của những quá trình này là sự việc thay đổi entanpi:
Q. P u003d -Δ N.
Đối với những quá trình xảy ra ở thể tích và nhiệt độ không đổi (T = const, V = const) Q. V = -Δ U.
Đối với phản ứng tỏa nhiệt Δ H< 0, а в случае протекания эндотермической реакции Δ Н >0. Ví dụ,
N 2 (g) + SO 2 (g) u003d N 2 O (g); ΔН 298 = + 82kJ,
CH 4 (g) + 2O 2 (g) u003d CO 2 (g) + 2H 2 O (g); ΔN 298 = -802kJ.
Các phương trình hóa học trong đó biểu thị thêm hiệu ứng nhiệt của phản ứng (giá trị của quá trình DH), cũng như trạng thái tập hợp những chất và nhiệt độ, được gọi là nhiệt hóa những phương trình.
Trong phương trình nhiệt hóa, trạng thái pha và những biến hóa dị vị trí hướng của thuốc thử và những chất tạo thành được để ý quan tâm: d - thể khí, g - lỏng, k - tinh thể; S (hình thoi), S (một mặt), C (than chì), C (kim cương), v.v.
6.1.3. Hóa chất nhiệt điện; Luật Hess
Các hiện tượng kỳ lạ năng lượng đi kèm với những nghiên cứu và phân tích những quá trình vật lý và hóa học nhiệt hóa học. Định luật cơ bản của nhiệt hóa là định luật do nhà khoa học người Nga G.I. Hess vào năm 1840.
Định luật Hess ': sự thay đổi entanpi của quá trình phụ thuộc vào dạng và trạng thái của nguyên vật liệu ban đầu và sản phẩm phản ứng, nhưng không phụ thuộc vào đường đi của quá trình.
Khi xem xét những hiệu ứng nhiệt hóa, khái niệm “entanpi của quá trình” thường được sử dụng thay cho khái niệm “sự thay đổi entanpi của quá trình”, nghĩa là theo khái niệm này giá trị Δ H. Sẽ không đúng chuẩn nếu sử dụng khái niệm “hiệu ứng nhiệt của quá trình ”khi xây dựng định luật Hess, vì giá trị Q. nói chung không phải là một hàm của trạng thái. Như đã nói ở trên, chỉ ở áp suất không đổi Q. P = -Δ N (ở thể tích không đổi Q. V = -Δ U).
Vì vậy, sự hình thành PCl 5 hoàn toàn có thể được xem là kết quả của sự việc tương tác của những chất đơn giản:
P (c, trắng) + 5 / 2Cl 2 (g) = PCl 5 (c); Δ H 1,
hoặc là kết quả của một quá trình ra mắt trong nhiều quá trình:
P (k, trắng) + 3 / 2Cl 2 (g) = PCl 3 (g); Δ H 2,
PCl 3 (g) + Cl 2 (g) u003d PCl 5 (c); Δ H 3,
hoặc tổng cộng:
P (c, trắng) + 5 / 2Cl 2 (g) = PCl 5 (c); Δ H 1 u003d Δ H 2 + Δ H 3.
6.1.4. Entanpi của sự việc hình thành những chất
Entanpi của sự việc hình thành là entanpi của quá trình hình thành một chất ở một trạng thái tập hợp nhất định từ những chất đơn giản đang ở trạng thái biến hóa ổn định. Ví dụ, entanpi của sự việc hình thành natri sunfat là entanpi của phản ứng:
2Na (c) + S (hình thoi) + 2O 2 (g) u003d Na 2 SO 4 (c).
Entanpi tạo thành những chất đơn giản bằng không.
Vì hiệu ứng nhiệt của phản ứng phụ thuộc vào trạng thái của những chất, nhiệt độ và áp suất nên người ta đồng ý sử dụng entanpi tiêu chuẩn của sự việc hình thành là entanpi của sự việc hình thành những chất ở nhiệt độ nhất định trong điều kiện tiêu chuẩn. Là trạng thái đúng cho những chất ở trạng thái ngưng tụ, trạng thái thực của chất đó ở nhiệt độ và áp suất cho trước là 101,325 kPa (1 atm). Sách tham khảo thường đưa ra entanpi chuẩn của sự việc hình thành những chất ở nhiệt độ 25 o C (298K), quy về 1 mol chất (Δ H f o 298). Entanpi chuẩn của sự việc hình thành một số trong những chất ở T = 298K được cho trong Bảng. 6.1.
Bảng 6.1.
Entanpi chuẩn của sự việc hình thành (Δ H f o 298) của một số trong những chất
Chất
Δ H f o 298, kJ / mol
Chất
Δ H f o 298, kJ / mol
Các entanpi tiêu chuẩn của sự việc hình thành đối với hầu hết những chất phức tạp là những giá trị âm. Đối với một số trong những nhỏ những chất không bền, Δ H f o 298> 0. Các chất đó, đặc biệt, gồm có oxit nitric (II) và oxit nitric (IV), Bảng 6.1.
6.1.5. Tính hiệu ứng nhiệt của phản ứng hóa học
Để tính toán entanpi của những quá trình, một hệ quả của định luật Hess được sử dụng: entanpi của phản ứng bằng tổng entanpi tạo thành sản phẩm phản ứng trừ đi tổng entanpi tạo thành những chất ban đầu, có tính đến thông số phân tích.
Tính entanpi của quá trình phân hủy canxi cacbonat. Quá trình này được mô tả bằng phương trình sau:
CaCO 3 (c) u003d CaO (c) + CO 2 (g).
Entanpi của phản ứng này sẽ bằng tổng entanpi của sự việc hình thành canxi oxit và carbon dioxide trừ đi entanpi của sự việc hình thành canxi cacbonat:
Δ H o 298 u003d Δ H f o 298 (CaO (c)) + Δ H f o 298 (CO 2 (g)) - Δ H f o 298 (CaCO 3 (c)).
Sử dụng tài liệu trong Bảng 6.1. chúng tôi nhận được:
Δ H o 298 = - 635,1 -393,5 + 1206,8 = + 178,2 kJ.
Từ tài liệu thu được, phản ứng được xem là thu nhiệt, tức là tiến hành quá trình hấp thụ nhiệt.
CaO (c) + CO 2 (c) u003d CaCO 3 (c)
Kèm theo đó là sự việc tỏa nhiệt. Entanpi của nó sẽ bằng
Δ H o 298 = -1206,8 + 635,1 + 393,5 = -178,2 kJ.
6.2. Tốc độ phản ứng hóa học
6.2.1. Khái niệm về tốc độ phản ứng
Ngành hóa học liên quan đến tốc độ và cơ chế của những phản ứng hóa học được gọi là động học hóa học. Một trong những khái niệm quan trọng trong động học hóa học là tốc độ của một phản ứng hóa học.
Tốc độ của một phản ứng hóa học được xác định bằng sự thay đổi nồng độ của những chất tham gia trong một đơn vị thời gian ở một thể tích không đổi của hệ.
Hãy xem xét quá trình sau:
Để tại thời điểm t 1 nồng độ của chất A bằng giá trị c 1 và ở thời điểm t 2 - giá trị c 2. Trong khoảng chừng thời gian từ t 1 đến t 2, sự thay đổi nồng độ sẽ là Δ c u003d c 2 - c 1. Tốc độ phản ứng trung bình là:
Dấu trừ được đặt vì khi phản ứng tiếp tục (Δ t> 0), nồng độ của chất giảm (Δ c< 0), в то время, как скорость реакции является положительной величиной.
Tốc độ của một phản ứng hóa học phụ thuộc vào bản chất của chất phản ứng và vào điều kiện phản ứng: nồng độ, nhiệt độ, sự xuất hiện của chất xúc tác, áp suất (đối với phản ứng khí) và một số trong những yếu tố khác. Đặc biệt, khi diện tích s quy hoạnh tiếp xúc của những chất tăng lên thì tốc độ phản ứng càng tăng. Tốc độ phản ứng cũng tăng khi tăng tốc độ khuấy của những chất phản ứng.
Trị số của tốc độ phản ứng cũng phụ thuộc vào thành phần nào được sử dụng để tính tốc độ phản ứng. Ví dụ, tốc độ của quá trình
H 2 + I 2 u003d 2HI,
Tính từ sự thay đổi nồng độ HI gấp hai tốc độ phản ứng được tính từ sự thay đổi nồng độ của thuốc thử H 2 hoặc I 2.
6.2.2. Sự phụ thuộc của tốc độ phản ứng vào nồng độ; thứ tự và số mol của phản ứng
Định luật cơ bản của động học hóa học là Luật hành vi tập thể- thiết lập sự phụ thuộc của tốc độ phản ứng vào nồng độ của những chất phản ứng.
Tốc độ phản ứng tỷ lệ với tích nồng độ của những chất phản ứng. Đối với một phản ứng được viết ở dạng tổng quát là
aA + bB = cC + dD,
sự phụ thuộc của tốc độ phản ứng vào nồng độ có dạng:
v = k [A] α [B] β.
Trong phương trình động học này, k là thông số tỉ lệ, được gọi là tỷ lệ không đổi; [A] và [B] là nồng độ của những chất A và B. Hằng số tốc độ phản ứng k phụ thuộc vào bản chất của những chất tham gia phản ứng và vào nhiệt độ, nhưng không phụ thuộc vào nồng độ của chúng. Hệ số α và β được tìm thấy từ tài liệu thực nghiệm.
Tổng những số mũ trong phương trình động học được gọi là tổng theo thứ tự những phản ứng. Cũng có một thứ tự rõ ràng của phản ứng trong một trong những thành phần. Ví dụ, đối với phản ứng
H 2 + C1 2 u003d 2 HC1
Phương trình động học có dạng như sau:
v = k 1/2,
những thứ kia. bậc tổng thể là một trong,5 và bậc phản ứng đối với H 2 và C1 2 thành phần tương ứng là một trong và 0,5.
Tính phân tử phản ứng được xác định bởi số lượng những hạt, sự va chạm đồng thời là hành vi cơ bản của tương tác hóa học. Hành động sơ đẳng (quá trình sơ cấp)- một hành vi tương tác hoặc biến hóa những hạt (phân tử, ion, gốc) thành những hạt khác. Đối với những phản ứng cơ bản, số mol và thứ tự của phản ứng là như nhau. Nếu quá trình là nhiều quá trình và do đó phương trình phản ứng không tiết lộ cơ chế của quá trình, thứ tự của phản ứng không trùng với số mol của nó.
Phản ứng hóa học được phân thành đơn giản (một quá trình) và phức tạp, xảy ra trong một số trong những quá trình.
Phản ứng đơn phân tử là một phản ứng trong đó hành vi cơ bản là một sự biến hóa hóa học của một phân tử. Ví dụ:
CH 3 CHO (g) u003d CH 4 (g) + CO (g).
Phản ứng phân tử- phản ứng trong đó hành vi cơ bản được thực hiện khi hai hạt va chạm. Ví dụ:
H 2 (g) + I 2 (g) u003d 2 HI (g).
phản ứng ba phân tử- một phản ứng đơn giản, hành vi cơ bản được thực hiện với sự va chạm đồng thời của ba phân tử. Ví dụ:
2NO (g) + O 2 (g) u003d 2 NO 2 (g).
Thực tế là không thể xảy ra va chạm đồng thời của hơn ba phân tử, dẫn đến hình thành những sản phẩm phản ứng.
Quy luật tác dụng của khối lượng không áp dụng cho những phản ứng liên quan đến chất rắn, vì nồng độ của chúng không đổi và chúng chỉ phản ứng trên mặt phẳng. Tốc độ của những phản ứng như vậy phụ thuộc vào kích thước của mặt phẳng tiếp xúc Một trong những chất phản ứng.
6.2.3. Sự phụ thuộc nhiệt độ của tốc độ phản ứng
Tốc độ phản ứng hóa học tăng khi nhiệt độ tăng. Sự ngày càng tăng này là vì động năng của những phân tử tăng lên. Năm 1884, nhà hóa học người Hà Lan van't Hoff đã đưa ra quy tắc: cứ nhiệt độ tăng 10 độ thì tốc độ phản ứng hóa học tăng lên gấp 2-4 lần.
Quy tắc của Van't Hoff được viết là:
 ,
, trong đó V t 1 và V t 2 là tốc độ phản ứng ở nhiệt độ t 1 và t 2; γ - thông số nhiệt độ của tốc độ, bằng 2 - 4.
Quy tắc van't Hoff được sử dụng để ước tính ảnh hưởng của nhiệt độ đến tốc độ phản ứng. Một phương trình đúng chuẩn hơn mô tả sự phụ thuộc của hằng số tốc độ phản ứng vào nhiệt độ được đề xuất vào năm 1889 bởi nhà khoa học Thụy Điển S. Arrhenius:
 .
. Trong phương trình Arrhenius, A là hằng số, E là năng lượng hoạt hóa (J / mol); T là nhiệt độ, K.
Theo Arrhenius, không phải mọi va chạm của những phân tử đều dẫn đến biến hóa hóa học. Chỉ những phân tử có năng lượng dư thừa mới hoàn toàn có thể phản ứng. Năng lượng dư thừa này mà những hạt va chạm phải có để phản ứng xảy ra giữa chúng được gọi là năng lương̣̣ kich hoaṭ.
6.3. Khái niệm về xúc tác và chất xúc tác
Chất xúc tác là chất làm thay đổi tốc độ của phản ứng hóa học nhưng không thay đổi về mặt hóa học khi kết thúc phản ứng.
Một số chất xúc tác làm tăng tốc độ phản ứng, trong khi những chất khác, được gọi là chất ức chế, làm đình trệ. Ví dụ, thêm một lượng nhỏ MnO 2 làm chất xúc tác vào hydro peroxit H2O2 gây ra sự phân hủy nhanh gọn:
2 H 2 O 2 - (MnO 2) 2 H 2 O + O 2.
Khi có một lượng nhỏ axit sulfuric, tốc độ phân hủy H 2 O 2 giảm. Trong phản ứng này, axit sunfuric hoạt động và sinh hoạt giải trí như một chất ức chế.
Tùy thuộc vào việc chất xúc tác ở cùng pha với những chất phản ứng hoặc tạo thành một pha độc lập, có đồng nhất và xúc tác không đồng nhất.
xúc tác đồng nhất
Trong trường hợp xúc tác đồng thể, những chất phản ứng và chất xúc tác ở cùng một pha, ví dụ, ở thể khí. Cơ chế hoạt động và sinh hoạt giải trí của chất xúc tác nhờ vào thực tế là nó tương tác với những chất phản ứng để tạo thành những hợp chất trung gian.
Xem xét cơ chế hoạt động và sinh hoạt giải trí của chất xúc tác. Trong trường hợp không còn chất xúc tác, phản ứng
Nó chảy rất chậm. Chất xúc tác tạo thành với những nguyên vật liệu ban đầu (ví dụ, với chất B) một sản phẩm trung gian phản ứng:
phản ứng mạnh mẽ và tự tin với một nguyên vật liệu ban đầu khác để tạo thành sản phẩm phản ứng ở đầu cuối:
VK + A u003d AB + K.
Xúc tác đồng thể ra mắt, ví dụ, trong quá trình oxy hóa lưu huỳnh (IV) oxit thành lưu huỳnh (VI) oxit, xảy ra với sự xuất hiện của oxit nitơ.
phản ứng đồng nhất
2 SO 2 + O 2 u003d 2 SO 3
trong trường hợp không còn chất xúc tác là rất chậm. Nhưng khi một chất xúc tác (NO) được đưa vào, một hợp chất trung gian (NO2) được hình thành:
O 2 + 2 KHÔNG u003d 2 KHÔNG 2,
SO 2 dễ bị oxi hóa:
KHÔNG 2 + SO 2 u003d SO 3 + KHÔNG.
Năng lượng hoạt hóa của quá trình sau này rất thấp nên phản ứng tiến hành với tốc độ cao. Do đó, hoạt động và sinh hoạt giải trí của chất xúc tác bị hạ xuống làm giảm năng lượng hoạt hóa của phản ứng.
xúc tác không đồng nhất
Trong xúc tác dị thể, chất xúc tác và chất phản ứng ở những pha rất khác nhau. Chất xúc tác thường ở trạng thái rắn và những chất phản ứng ở trạng thái lỏng hoặc khí. Trong xúc tác dị thể, sự tăng tốc của quá trình thường gắn với hiệu ứng xúc tác của mặt phẳng chất xúc tác.
Các chất xúc tác rất khác nhau về tính tinh lọc (tính tinh lọc) của hoạt động và sinh hoạt giải trí. Vì vậy, ví dụ, với sự xuất hiện của chất xúc tác nhôm oxit Al 2 O 3 ở 300 o C, nước và etylen thu được từ rượu etylic:
C 2 H 5 OH - (Al 2 O 3) C 2 H 4 + H 2 O.
Ở cùng nhiệt độ, nhưng khi có đồng Cu làm xúc tác, ancol etylic bị khử hiđro:
C 2 H 5 OH - (Cu) CH 3 CHO + H 2.
Một lượng nhỏ những chất nhất định làm giảm hoặc thậm chí phá hủy hoàn toàn hoạt tính của chất xúc tác (ngộ độc chất xúc tác). Những chất như vậy được gọi là chất độc xúc tác. Ví dụ, oxy gây ngộ độc thuận nghịch chất xúc tác sắt trong quá trình tổng hợp NH 3. Hoạt động của chất xúc tác hoàn toàn có thể được phục hồi bằng phương pháp cho một hỗn hợp nitơ và hydro mới được tinh chế từ oxy đi qua. Lưu huỳnh gây ngộ độc không hồi sinh chất xúc tác trong quá trình tổng hợp NH 3. Hoạt động của nó không hề tồn tại thể được phục hồi bằng phương pháp cho hỗn hợp N 2 + H 2 mới đi qua.
Các chất tăng cường hoạt động và sinh hoạt giải trí của chất xúc tác được gọi là người quảng bá, hoặc chất kích hoạt(ví dụ, xúc tác xúc tác platin được thực hiện bằng phương pháp thêm sắt hoặc nhôm).
Cơ chế của xúc tác dị thể phức tạp hơn. Để lý giải nó, lý thuyết hấp phụ của xúc tác được sử dụng. Bề mặt của chất xúc tác là không đồng nhất, vì vậy nó được gọi là những tâm hoạt động và sinh hoạt giải trí. Các chất phản ứng được hấp phụ trên những vị trí hoạt động và sinh hoạt giải trí. Quá trình thứ hai gây ra sự tiếp cận của những phân tử phản ứng và tăng hoạt tính hóa học của chúng, vì link Một trong những nguyên tử của những phân tử bị hấp phụ bị yếu đi, khoảng chừng cách Một trong những nguyên tử tăng lên.
Mặt khác, người ta tin rằng tác dụng tăng tốc của chất xúc tác trong xúc tác dị thể là vì những chất phản ứng tạo thành những hợp chất trung gian (như trong trường hợp xúc tác đồng thể), dẫn đến giảm năng lượng hoạt hóa.
6.4. Cân bằng hóa học
Phản ứng thuận nghịch và thuận nghịch
Các phản ứng chỉ ra mắt theo một chiều và kết thúc bằng sự biến hóa hoàn toàn những chất ban đầu thành những chất ở đầu cuối được gọi là phản ứng không thuận nghịch.
Không thể đảo ngược, tức là tiến đến phần cuối là những phản ứng trong đó
Phản ứng hóa học hoàn toàn có thể đi ngược chiều được gọi là phản ứng thuận nghịch. Các phản ứng thuận nghịch điển hình là phản ứng tổng hợp amoniac và oxi hóa lưu huỳnh (IV) oxit thành lưu huỳnh (VI) oxit:
N 2 + 3 H 2 2 NH 3,
2 SO 2 + O 2 2 SO 3.
Khi viết phương trình của những phản ứng thuận nghịch, thay dấu bằng ta đặt hai mũi tên chỉ ngược chiều nhau.
Trong những phản ứng thuận nghịch, tốc độ của phản ứng trực tiếp tại thời điểm ban đầu có mức giá trị cực lớn, tốc độ này giảm khi nồng độ của thuốc thử ban đầu giảm. trái lại, phản ứng nghịch ban đầu có tốc độ tối thiểu, tốc độ này tăng khi nồng độ của những sản phẩm tăng. Kết quả là, có thuở nào điểm khi tốc độ của phản ứng thuận và nghịch trở nên bằng nhau và cân đối hóa học được thiết lập trong khối mạng lưới hệ thống.
Cân bằng hóa học
Trạng thái của một hệ những chất phản ứng trong đó tốc độ của phản ứng thuận trở nên bằng tốc độ của phản ứng nghịch được gọi là trạng thái cân đối hóa học.
Cân bằng hóa học còn được gọi là cân đối thực. Ngoài sự bằng nhau của tốc độ phản ứng thuận và nghịch, cân đối hóa học thực sự được đặc trưng bởi những đặc điểm sau:
Tính không bao giờ thay đổi của trạng thái của hệ là vì dòng phản ứng thuận và nghịch, tức là trạng thái cân đối là động;
trạng thái của khối mạng lưới hệ thống không thay đổi theo thời gian nếu không còn tác động bên phía ngoài vào khối mạng lưới hệ thống;
bất kỳ tác động bên phía ngoài nào gây ra sự thay đổi trạng thái cân đối của khối mạng lưới hệ thống; tuy nhiên, nếu ảnh hưởng bên phía ngoài được vô hiệu, thì khối mạng lưới hệ thống sẽ trở lại trạng thái ban đầu một lần nữa;
trạng thái của khối mạng lưới hệ thống là như nhau bất kể khối mạng lưới hệ thống tiếp cận trạng thái cân đối từ phía nào - từ phía của những chất ban đầu hoặc từ phía của những sản phẩm phản ứng.phải được phân biệt với thực trạng thái cân đối rõ ràng. Vì vậy, ví dụ, một hỗn hợp oxy và hydro trong một bình kín ở nhiệt độ phòng hoàn toàn có thể được tàng trữ trong thuở nào gian dài tùy ý. Tuy nhiên, việc khởi đầu phản ứng (phóng điện, chiếu tia cực tím, tăng nhiệt độ) làm cho phản ứng tạo nước ra mắt không thể đảo ngược.
6.5. Nguyên tắc của Le Chatelier
Ảnh hưởng của những thay đổi của điều kiện bên phía ngoài đến vị trí cân đối được xác định bởi Nguyên tắc Le Chatel e (France, 1884): nếu bất kỳ ảnh hưởng bên phía ngoài nào được tạo ra đối với một hệ đang ở trạng thái cân đối, thì trạng thái cân đối trong hệ sẽ chuyển dời theo hướng làm suy yếu ảnh hưởng này.
Nguyên lý của Le Chatelier không riêng gì có áp dụng cho những quá trình hóa học mà còn cho những quá trình vật lý, ví dụ như sôi, kết tinh, hòa tan, v.v.
Xem xét ảnh hưởng của những yếu tố rất khác nhau đến cân đối hóa học bằng phương pháp sử dụng phản ứng tổng hợp amoniac làm ví dụ:
N 2 + 3 H 2 2 NH 3; ΔH = -91,8 kJ.
Ảnh hưởng của nồng độ đến cân đối hóa học.
Theo nguyên tắc Le Chatelier, sự ngày càng tăng nồng độ của những chất ban đầu sẽ làm dịch chuyển trạng thái cân đối theo hướng hình thành những sản phẩm phản ứng. Sự ngày càng tăng nồng độ của những sản phẩm phản ứng làm thay đổi trạng thái cân đối theo hướng hình thành những chất ban đầu.
Trong quá trình tổng hợp amoniac đã xét ở trên, việc đưa thêm một lượng N 2 hoặc H 2 vào hệ cân đối gây ra sự chuyển dời cân đối theo hướng giảm nồng độ của những chất này, do đó, cân đối chuyển dời theo hướng hình thành của NH3. Tăng nồng độ amoniac làm thay đổi trạng thái cân đối đối với những nguyên vật liệu ban đầu.
Một chất xúc tác làm tăng tốc độ của tất cả phản ứng thuận và nghịch như nhau, vì vậy sự ra đời của một chất xúc tác không ảnh hưởng đến cân đối hóa học.
Ảnh hưởng của nhiệt độ đến cân đối hóa học
Khi nhiệt độ tăng, cân đối chuyển dời theo phản ứng thu nhiệt và khi nhiệt độ giảm, cân đối chuyển sang phản ứng tỏa nhiệt.
Mức độ chuyển dời của cân đối được xác định bởi giá trị tuyệt đối của hiệu ứng nhiệt: giá trị ΔH của phản ứng càng lớn thì ảnh hưởng của nhiệt độ càng lớn.
Trong phản ứng tổng hợp amoniac đang được xem xét, sự ngày càng tăng nhiệt độ sẽ chuyển trạng thái cân đối về phía những nguyên vật liệu ban đầu.
Ảnh hưởng của áp suất đến cân đối hóa học
Sự thay đổi áp suất ảnh hưởng đến trạng thái cân đối hóa học với sự tham gia của những chất ở thể khí. Theo nguyên tắc Le Chatelier, sự ngày càng tăng áp suất làm thay đổi trạng thái cân đối theo vị trí hướng của một phản ứng xảy ra với sự giảm thể tích của những chất ở thể khí và sự giảm áp suất sẽ làm dịch chuyển cân đối theo hướng ngược lại. Phản ứng tổng hợp amoniac tiến hành với sự giảm thể tích của hệ (có bốn thể tích ở bên trái của phương trình và hai thể tích ở bên phải). Do đó, sự ngày càng tăng áp suất làm thay đổi trạng thái cân đối theo hướng hình thành amoniac. Sự giảm áp suất sẽ làm chuyển dời cân đối theo chiều ngược lại. Nếu trong phương trình của một phản ứng thuận nghịch mà số phân tử của những chất ở thể khí ở hai phần bên phải và bên trái bằng nhau (phản ứng tiến hành mà không làm thay đổi thể tích những chất ở thể khí) thì áp suất không ảnh hưởng đến vị trí cân đối trong hệ này.
Bất kỳ phản ứng hóa học nào thì cũng kèm theo sự giải phóng hoặc hấp thụ năng lượng dưới dạng nhiệt.
Trên cơ sở giải phóng hoặc hấp thụ nhiệt, người ta phân biệt tỏa nhiệt và thu nhiệt những phản ứng.
tỏa nhiệt phản ứng - những phản ứng như vậy trong đó nhiệt được tỏa ra (+ Q.).
Phản ứng thu nhiệt - phản ứng trong đó nhiệt bị hấp thụ (-Q.).
Hiệu ứng nhiệt của phản ứng (Q.) là nhiệt lượng tỏa ra hoặc hấp thụ trong quá trình tương tác của một lượng thuốc thử ban đầu nhất định.
Phương trình nhiệt hóa là phương trình biểu thị tác dụng nhiệt của phản ứng hóa học. Ví dụ, những phương trình nhiệt hóa là:
Cũng cần lưu ý rằng phương trình nhiệt hóa nhất thiết phải gồm có thông tin về trạng thái tổng hợp của chất phản ứng và sản phẩm, vì giá trị của hiệu ứng nhiệt phụ thuộc vào điều này.
Tính toán nhiệt phản ứng
Ví dụ về một bài toán điển hình để tìm hiệu ứng nhiệt của phản ứng:
Khi cho 45 g glucozơ tương tác với một lượng dư oxi theo phương trình
C 6 H 12 O 6 (rắn) + 6O 2 (g) u003d 6CO 2 (g) + 6H 2 O (g) + Q.
700 kJ nhiệt được tỏa ra. Xác định hiệu ứng nhiệt của phản ứng. (Viết lại số đó đến số nguyên sớm nhất.)
Quyết định:
Tính khối lượng chất glucozơ:
n (C 6 H 12 O 6) u003d m (C 6 H 12 O 6) / M (C 6 H 12 O 6) u003d 45 g / 180 g / mol u003d 0,25 mol
Những thứ kia. Sự tương tác của 0,25 mol glucozơ với oxi tỏa ra nhiệt lượng 700 kJ. Từ phương trình nhiệt hoá đã trình bày ở điều kiện, ta thấy khi một mol glucozơ tương tác với oxi sẽ tạo thành một lượng nhiệt bằng Q. (nhiệt của phản ứng). Khi đó tỷ lệ sau là đúng:
0,25 mol glucozơ - 700 kJ
1 mol glucozơ - Q.
Từ tỷ trọng này theo phương trình tương ứng:
0,25 / 1 = 700 / Q.
Giải quyết vấn đề đó, chúng tôi thấy rằng:
Như vậy, hiệu ứng nhiệt của phản ứng là 2800 kJ.
Các phép tính theo phương trình nhiệt hóa
Thông thường hơn, trong những bài tập USE trong nhiệt hóa học, giá trị của hiệu ứng nhiệt đã được biết trước, chính bới. phương trình nhiệt hóa hoàn hảo nhất được cho trong điều kiện.
Trong trường hợp này, nên phải tính toán lượng nhiệt tỏa ra / hấp thụ với một lượng chất phản ứng hoặc sản phẩm đã biết, hoặc ngược lại, giá trị nhiệt lượng đã biết được yêu cầu để xác định khối lượng, thể tích hoặc lượng của một chất bất kỳ tham gia vào phản ứng.
ví dụ 1
Phù phù phù hợp với phương trình phản ứng nhiệt hóa
3Fe 3 O 4 (rắn) + 8Al (rắn) u003d 9Fe (rắn) + 4Al 2 O 3 (rắn) + 3330 kJ
tạo thành 68 g nhôm oxit. Nhiệt lượng tỏa ra trong trường hợp này là bao nhiêu? (Viết lại số đó đến số nguyên sớm nhất.)
Quyết định
Tính khối lượng chất nhôm oxit:
n (Al 2 O 3) u003d m (Al 2 O 3) / M (Al 2 O 3) u003d 68 g / 102 g / mol u003d 0,667 mol
Theo phương trình nhiệt hóa của phản ứng, 3330 kJ được giải phóng trong quá trình tạo thành 4 mol nhôm oxit. Trong trường hợp của chúng tôi, 0,6667 mol nhôm oxit được tạo thành. Biểu thị nhiệt lượng tỏa ra trong trường hợp này, thông qua x kJ, tất cả chúng ta sẽ tính theo tỷ lệ:
4 mol Al 2 O 3 - 3330 kJ
0,667 mol Al 2 O 3 - x kJ
Tỷ lệ này tương ứng với phương trình:
4 / 0,6667 = 3330 / x
Giải ra ta thấy x = 555 kJ
Những thứ kia. Khi tạo thành 68 g nhôm oxit theo phương trình nhiệt hoá, nhiệt lượng toả ra ở điều kiện là 555 kJ.
Ví dụ 2
Kết quả của phản ứng, phương trình nhiệt hóa trong đó
4FeS 2 (rắn) + 11O 2 (g) u003d 8SO 2 (g) + 2Fe 2 O 3 (rắn) + 3310 kJ
1655 kJ nhiệt được tỏa ra. Xác định thể tích (l) lưu huỳnh đioxit thoát ra (n.o.s.). (Viết lại số đó đến số nguyên sớm nhất.)
Quyết định
Theo phương trình phản ứng nhiệt hóa, 8 mol SO 2 tạo thành nhiệt lượng 3310 kJ. Trong trường hợp của chúng tôi, 1655 kJ nhiệt đã được giải phóng. Gọi khối lượng chất SO 2 tạo thành trong trường hợp này bằng x mol. Khi đó tỷ lệ sau là hợp lệ:
8 mol SO 2 - 3310 kJ
x mol SO 2 - 1655 kJ
Từ đó theo phương trình:
8 / x = 3310/1655
Giải quyết vấn đề đó, chúng tôi thấy rằng:
Như vậy lượng chất SO 2 tạo thành trong trường hợp này là 4 mol. Do đó, khối lượng của nó là:
V (SO 2) u003d V m ∙ n (SO 2) u003d 22,4 l / mol ∙ 4 mol u003d 89,6 l ≈ 90 l(làm tròn đến số nguyên, vì điều này là bắt buộc trong điều kiện.)
Có thể tìm thêm những bài toán phân tích về hiệu ứng nhiệt của phản ứng hóa học.
Tải thêm tài liệu liên quan đến nội dung bài viết Cách tính hiệu ứng nhiệt của phản ứng